新規アルツハイマー病治療薬・抗Aβ抗体の特徴と新たな診療体制の構築について
公開日:2024年5月 1日 09時00分
更新日:2024年8月13日 15時49分
井原 涼子(いはら りょうこ)
東京都健康長寿医療センター脳神経内科医長
はじめに
アルツハイマー病の病態に作用して進行を遅らせる薬として、2023年9月に本邦では初となるレカネマブ(商品名:レケンビ®)が承認された。同年12月20日に保険収載され、同年末より実際に投与が開始された。本薬は既承認の認知症薬とは全く作用機序の異なる薬で、一部の分子標的薬と同様、「最適使用推進ガイドライン」が定められている。投与対象の選定や投与後の追跡、副作用対応などでこれまでとは違う診療体制が必要となり、本稿ではどのような特徴の薬で、どのような点に注意する必要があるか解説する。
抗Aβ抗体レカネマブの作用機序と特徴
アルツハイマー病(Alzheimer's disease,AD)の分子病態は、次のアミロイド仮説で説明される。1.アミロイド前駆体蛋白質からアミロイドβ(amyloidβ,Aβ)が切り出されて細胞外に放出され、2.何らかの原因で産生・分解のバランスが崩れ、細胞外のAβが過剰になると徐々に凝集し、3.凝集の過程で生じる凝集中間体がシナプス毒性を発揮する。4.その結果、神経細胞内のタウ蛋白質の異常リン酸化を生じ、5.神経細胞死に至り、6.臨床症状として認知機能障害を呈する1)。このようなADの病態カスケードのいずれかの過程に抑制的に働き、進行を抑制する薬を疾患修飾薬と呼ぶ。様々な作用機序の疾患修飾薬が20年以上にわたって開発されてきたが、ようやく2021年6月に抗Aβ抗体のアデュカヌマブが米国で迅速承認にこぎつけた。しかしながら、アデュカヌマブは2つの第3相試験のうち1つでしか主要評価項目を達成しなかったことから米国でもフル承認を得られず、日欧では承認に至らなかった。それに遅れて2022年11月、同じく抗Aβ抗体のレカネマブの第3相試験も主要評価項目を達成したことが公表され、その結果をもって米国では2023年1月に迅速承認後7月にフル承認、本邦でも同年9月に承認となった。
従来用いられてきたAD治療薬はアミロイド仮説の病態に作用するものではなく、臨床症状を緩和することを目的とした薬であった。Aβを除去することを目的とするレカネマブは、作用機序や使用の前提が全く異なることに注意されたい。また、従来の症状改善薬はアルツハイマー型認知症に対して適応を有しているのに対し、レカネマブはADによる軽度認知障害~軽度の認知症に対する薬であり、軽度認知障害に適応のある初めての薬となった。さらに、抗体医薬品という性質から、レカネマブは2週ごとに静脈点滴で投与する薬である。
レカネマブの有効性と副作用
ADによる軽度認知障害~軽度の認知症を対象に18か月間投与を行ったレカネマブの第3相試験では、日常生活での認知症の重症度評価であるCDR-SB(Clinical Dementia Rating-Sum of Boxes)が主要評価項目に設定され、18か月時点で進行を27%抑制した。他の認知機能評価においても同程度の進行抑制効果が見られた2)。また、実際に脳内のAβ蓄積を陰性レベルまで除去することが示された。AD疾患修飾薬治験では「臨床的意義(clinical meaningfulness)」が重視されているが、27%という進行抑制効果をどのように解釈するかは議論の余地がある。投与しても進行はするため、投与された患者や家族自身は効果を実感しにくいと思われる。ただし、18か月間で5.3か月分の時間をセーブしたと表現することもでき、今後実臨床において、レカネマブ使用による生活の質や医療経済に対する効果も調査されていくだろう。
注意すべき副作用としては、アミロイド関連画像異常(Amyloid Related Imaging Abnormalities,ARIA)と投与に伴う反応の2つがある。ARIAは最も気を付けるべき副作用で、抗Aβ抗体特有の副作用として知られる。ARIAには血管原性脳浮腫のARIA-Eと微小出血に代表されるARIA-Hがあり、レカネマブの第3相試験では、ARIA全体が実薬群の21%、ARIA-Eが12.6%、ARIA-Hが17.3%に見られた。レカネマブは、アデュカヌマブやドナネマブといった他の抗Aβ抗体と比較すると、ARIAの頻度が低いのが特徴である。これはそれぞれの抗Aβ抗体が標的とするAβ分子種に差異があるためと考えられる。ARIAは症状を伴わないことの方が多く、投与開始から3か月くらいまでのARIA発現の多い時期に頻回にMRI検査を行い確認することになる。また、ARIAはADのリスク遺伝子であるAPOEε4のアレル数に応じて頻度が高くなることが知られており、米国の添付文書では枠付き警告として、APOEε4ホモ接合体患者のARIA頻度の上昇を注意勧告し、投与前のAPOE遺伝子型検査を推奨している。ただし、本邦ではAPOE遺伝学的検査が保険未収載であり、最適使用推進ガイドラインにはその記載がなく、今後実臨床での使用状況を見ながらAPOE遺伝子型検査の実施について検討されていくと思われる。また、投与に伴う反応はアレルギー反応であり、第3相試験では実薬群の26.4%に認められた。こちらは抗体の免疫原性に起因する副作用で、レカネマブでは頻度の高い副作用として気に留める必要がある。
最適使用推進ガイドラインの定めるところ
前述したようなレカネマブの特徴から、医療機関側としては、1.投与前にAβ蓄積があることを確認するバイオマーカー検査(アミロイドPETまたは脳脊髄液バイオマーカー)が必要、2.2週間に1度の投与を行えるブースの確保が必要、3.副作用に対応できる体制(救急医療およびMRI)が必要という点で、これまでの認知症診療とは異なる。新しい診療体制が必要になることを想像いただけるだろう。患者側としても、副作用の他、2週間に1回の通院治療であること、費用が高額になることなど、ある種の覚悟が必要な治療である。
米国では2023年7月のフル承認を前に、レカネマブのAppropriate Use Recommencations(AUR)が公表されており3)、本邦でも同年12月の発売と同時に最適使用推進ガイドラインが発表された4)。筆者の所属する施設では、本邦での承認を見越して米国AURに基づいて準備を進めてきたが、本邦の最適使用推進ガイドラインを読んで驚いた点がある。1つは、本邦では原則18か月間と投与期間の区切りが定められたこと、もう1つは臨床的重症度の追跡評価として投与前および投与開始後6か月ごとのCDRの実施を義務付けたことである。後者について、米国AURには対象となる患者の臨床診断とMMSEの得点基準が設けられており、投与開始後の副作用への対応方針についても記載されているが、投与開始後は有効性の評価のための治験で実施したような認知機能の追跡については現実的ではないとし、投与患者を対象とした大規模レジストリーにて簡易評価の点数を収集するにとどめている。CDRは治験では頻用されるものの、実臨床ではあまり馴染みのない評価で、正しい手順で行うと1時間程度の時間を要する。
最適使用推進ガイドラインの定める要件について、表1に対象となる患者の条件、表2に医師要件・施設要件の要約を示した。MMSE22点以上の軽度認知障害~軽度の認知症を対象とするという基準は、第3相試験の適格性基準をそのまま踏襲しており、日米での差はない。医師要件はさほど厳しくないが、施設要件ではMRIを自施設内で実施可能との項目が設けられたことなど、要件が厳しいと感じた方が多かったのではなかろうか。ARIAに注意し、ARIA発現時には投与施設が責任をもって確実に対応せよという意図が反映されている。
表1 レカネマブの投与対象となる患者の条件
(最適使用推進ガイドライン4)を筆者要約)
表2 レカネマブ投与に際しての医師要件・施設要件、投与開始後の追跡について
(最適使用推進ガイドライン4)を筆者要約)
レカネマブ診療体制の構築
あくまで一例として、図に当院での診療の流れを提示する。レカネマブの適応評価・投与を行う専門外来として新たにDMT外来を設けたが、レカネマブ診療の全てをDMT外来が担うわけではない。当院では、以前より物忘れ外来・脳神経内科・精神科が認知症診療、特に地域の医療機関から紹介いただいた患者の鑑別診断を担っており、受診理由がレカネマブ希望であろうとなかろうと、診療の入り口を変えない方針とした。レカネマブを用いた診療では、バイオマーカー検査の枠に限りがあることが律速になると想定されるため、事前に適切に患者を絞り込むための鑑別診断と重症度評価の重要性は従来と変わらないのである。それらを行って適応と考えられ、かつ患者の意向がある場合には、DMT外来にご紹介いただく。レカネマブの適応基準に含まれるMMSEは、紹介元でも実施している場合があるが、公正な適応評価と投与後の追跡のためバージョンの統一が望ましいと考え、当院受診後に実施し直すことにした。また、投与前にARIA確認用プロトコルでMRIの撮像が必須となることから、鑑別診断を行う際の画像検査は頭部CTでよいこととした。
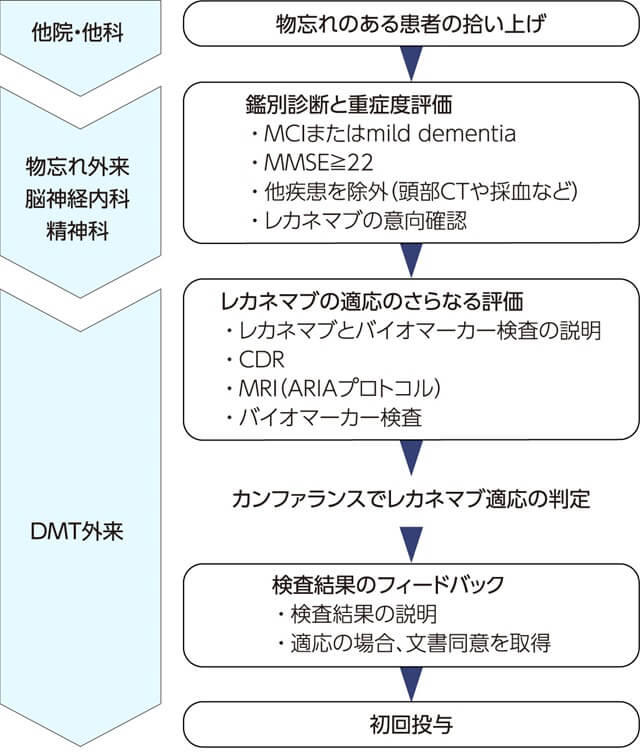
そのようにしてDMT外来に紹介された後、レカネマブの説明を行うが、メリットである有効性と、デメリットである副作用・通院負担・費用について文書を用いて話し、患者に意思を確認する。それから、バイオマーカー検査を含むさらなる適応評価を行い、チームカンファランスで適応の合意を得て、初回投与にこぎつけるという流れである。当院はAD疾患修飾薬の治験経験が豊富で、治験のスクリーニングの流れを圧縮したものとして設定した。今後実臨床での投与症例が増えるにつれて、簡略化可能な部分が出てくるかもしれない。
適応や治療継続可否を判断する上で、MRIやアミロイドPETといった画像評価の確認が欠かせず、放射線科との密な連携が必須である。また、MMSEやCDRのバージョンや実施手順の統一のため、心理士教育も望まれる。投与開始後の投与ブースの確保やMRI撮像枠の確保についても、院内各部署との調整が必要である。万が一症候性ARIAを生じた場合、神経系救急が初動を担うため、脳神経外科との合同勉強会も実施した。当院は1例目の投与を全国に先駆けて実施したことから問い合わせも多く、予約を取り扱う医療連携部門との調整も重要であった。最適使用推進ガイドラインでは、ARIAの発現頻度の落ち着いてくる6か月以降、他院での投与が許容されており、患者紹介だけでなく、継続投与においても地域の医療機関との協力体制を構築することが今後の課題である。
レカネマブ診療の均てん化
ARIA等の副作用への対応の観点から、診療は居住する地域で完結することが望ましい。しかしながら、前述したように、レカネマブの施設要件がやや厳しいことから、適応となる患者がレカネマブ診療にたどり着けない地域が出てくるのではないかと懸念される。今後、国レベルで全国のレカネマブ投与施設を把握しながら、空白となる地域を支援していくことが望まれる。また、早期に診療体制を構築した施設は、実際に生じた課題を整理しながら、新規に立ち上げる施設の模範となることが期待される。
おわりに
レカネマブの登場により認知症診療は大きく変わる。しかしレカネマブは疾患修飾薬の1剤目にすぎない。同じく抗Aβ抗体のドナネマブも本邦で現在承認申請中であり、2024年中に承認・保険収載される可能性がある。また、将来、異なる作用機序の疾患修飾薬も利用可能となれば、いかに使い分けるか、より専門的な判断が必要になる。また、大勢を占める疾患修飾薬の適応とならない患者をいかにサポートするかも課題である。こういったことは、分子標的薬を使い分けるがん領域ではすでに経験していることで、神経領域もようやくそれに追いついてきたということかもしれない。新しい認知症診療のはじめの一歩を踏み出したところだ。
文献
- Hardy J,Selkoe DJ.:The amyloid hypothesis of Alzheimer's disease:progress and problems on the road to therapeutics.Science.2002;297(5580):353-256.
- van Dyck CH,Swanson CJ,AisenP,et al.:Lecanemab in Early Alzheimer's Disease.N Engl J Med.2023;388(1):9-21.
- Cummings J,Apostolova L,Rabinovici GD, et al.:Lecanemab:Appropriate Use Recommendations.J Prev Alzheimers Dis.2023;10(3):362-377.
筆者

- 井原 涼子(いはら りょうこ)
- 東京都健康長寿医療センター脳神経内科医長
- 略歴
- 2002年:東京大学医学部医学科卒業、2004年:東京大学医学部附属病院神経内科医員、2006年:横浜労災病院神経内科専修医、2011年:東京大学大学院医学系研究科脳神経医学専攻修了、博士(医学)取得、2012年:東京大学医学部附属病院早期・探索開発推進室特任助教、2015年:Washington University in St.Louis,School of Medicine,Department of Neurology,Knight Alzheimer's Disease Research Center客員研究員、2017年:東京大学大学院医学系研究科神経病理学助教、2020年より現職
- 専門分野
- 神経内科学、認知症学
転載元
WEB版機関誌「Aging&Health」アンケート
WEB版機関誌「Aging&Health」のよりよい誌面作りのため、ご意見・ご感想・ご要望をお聞かせください。
お手数ではございますが、是非ともご協力いただきますようお願いいたします。
