第3章 認知症の診断 1.臨床的視点から
公開月:2019年10月
国立長寿医療研究センター もの忘れセンター長
櫻井 孝
1.はじめに
近年、認知症に対する社会の関心や理解は大きく変化した。「痴呆症」が「認知症」に変わった。10年前には認知症高齢者が救急疾患に罹患しても入院を断られることもあったが、今では認知症高齢者の退院支援に関心が集まっている。わが国の認知症の国家戦略である新オレンジプランも広く普及し、次世代「新々オレンジプラン」の策定も議論されているという。しかし一方、認知症高齢者の治療は足踏みが続いている。特に、アルツハイマー型認知症の病態改善薬の治験は失敗が続いている。今日のアルツハイマー型認知症の治験では、臨床診断に加えPET検査などでバイオマーカーも陽性であること(病態の確認)がほぼ必須となっている。また、認知症診療では「診断後支援」がしばしば議論に上り、認知症になっても家で長く穏やかに暮す」という当たり前の目標をどのように達成するかについての議論や工夫が進められている。
そこで本稿では、認知症の診断に加え、私ども国立長寿医療研究センターが10年間おこなってきた包括的認知症診療を含め紹介したい。認知症診断の基本は「認知症疾患診療ガイドライン2017」に整理されている1)。認知症の包括的診療では、認知症の予防、診断後支援という視点を診断の段階から組み入れ、①認知障害の進行予防、②生活能力の維持、③行動・心理症状(BPSD)の気づきと対応、④身体疾患(転倒、尿失禁など)の予防、⑤認知症をもつ人の気持ちを尊重、⑥介護負担の軽減、⑦地域連携を目的とする。
2.認知症と軽度認知障害
認知症の診断基準はこれまで何度も改訂が行われてきた。米国精神医学会による認知症の診断基準(DSM-5)は、現在最もよく使われている診断基準の一つである1、2、3)。1つ以上の認知領域、つまり複雑性注意(注意を維持したり、振り分けたりする能力)、実行機能(計画を立て適切に実行する能力)、学習及び記憶、言語(弁護を理解したり表出したりする能力)、知覚―運動(正しく知覚したり、道具を適切に使用したりする能力)、社会的認知(他人の気持ちに配慮したり、表情を適切に把握したりする能力)が障害され、それらの障害によって日常の社会生活や対人関係に支障を来たし、せん妄やその他の精神疾患(うつ病や統合失調症等)が除外されれば認知症と考える。
DSM-5の診断基準では、新たに"major neurocognitive disorder"という用語が提唱された。「記憶障害」が必須でなくなり、また、2つ以上の領域の認知機能の障害が必須であったが、1つ以上となった点が大きな違いである。この改訂により、アルツハイマー型認知症のみならず多くの認知症病型が包含される。
一方、軽度認知障害(Mild Cognitive Impairment:MCI)は、本人、もしくは周りの人からもの忘れがあると認識され、年齢に比し記憶力が低下している状態(1.5SD以下)と定義される4)。日常生活動作は概ね維持されており、認知症ではないが、その一部が認知症へ進展するハイリスク群と考えられる。Bruscoliらのシステマティックレビューでは、平均で年間約10%が認知症に転換すると報告されている5)。しかし一方、5年経過しても約半数は認知症に移行しないこと、逆に認知機能健常に回復する例もある。
3.認知症の原因疾患
認知症や認知症様症状をきたす疾患・病態には、アルツハイマー型認知症、血管性認知症のほか、多種の原因疾患や病態が含まれる(表1)1)。慢性硬膜下出血、正常圧水頭症などの脳外科的疾患、甲状腺機能低下症、ビタミンB12欠乏症等の内科的疾患の一部は、治療可能な認知症(treatable dementia)として扱われ、早期の診断と適切な治療や処置が求められる1、2)。

認知症の診断を考えるうえで大切なことは、認知症や認知症様症状をきたす疾患・病態は1つとは限らないことである。アルツハイマー型認知症に血管性認知症を合併する例、アルツハイマー型認知症に慢性硬膜下出血、あるいは正常圧水頭症の合併する例も少なくない。さらにtreatable dementiaを併せ持つこともある。また、アルツハイマー型認知症が疑われていた例でも、経過途中からパーキンソン症状が目立ち始め、レビー小体型認知症(DLB)と診断される場合もある。正確な診断は治療の要であり、経過のなかで症状に特徴的な変化がみられる場合には、柔軟に診断を検討することも重要である。
4.認知症の症状
認知症の症状は、記憶、言語、視空間認知などの認知機能症状とBPSDからなる。認知機能障害は疾患ごとの機能低下部位を反映するが、BPSDは認知機能障害を基盤に、身体的要因、環境的要因、心理的要因などの影響を受けて出現する1、2)。焦燥性興奮、攻撃性、脱抑制などの行動症状と、不安、うつ、幻覚・妄想をはじめとする心理症状からなる。BPSDは認知症の病型や病期によりその内容や頻度も異なる。
BPSDは、①入院・入所の誘因になる、②本人や介護者のQOLが低下する、③経済的な負担が高まる、④認知機能低下の進行リスクであるため重要である。BPSDは、早期の気付き、対応の工夫、環境の調整、対症的な薬物療法などで改善する可能性がある。
5.認知症に類似した状態との鑑別
認知症と区別すべき病態として、加齢に伴う正常な認知機能の低下(生理的健忘)、せん妄、うつ病、その他の学習障害や精神遅延がある1、2)。加齢に伴う健忘は、通常は体験に対する部分的な記憶障害であり進行は穏やかである。
うつ病とアルツハイマー型認知症の違いを表2に示した2)。
| うつ病 | アルツハイマー型認知症 | |
|---|---|---|
| 発症 | 週か月単位、何らかの契機 | 緩徐 |
| もの忘れの訴え方 | 強調する | 自覚がない、自覚あっても生活に支障ない |
| 答え方 | 否定的答え(わからない) | つじつまをあわせる |
| 思考内容 | 自責的、自罰的 | 他罰的 |
| 失見当 | 軽い割にADL障害強い | ADLの障害と一致 |
| 記憶障害 | 軽い割にADL障害強い、最近の記憶と昔の記憶に差がない | ADLの障害と一致、最近の記憶が主体 |
| 日内運動 | あり | 乏しい |
うつ病は生活史上の何らかの契機が認められることが多い。うつ病では本人は症状を強調するが、アルツハイマー型認知症では本人は過小評価することが多い。とりつくろうような答えはアルツハイマー型認知症に特徴的である。うつ病では自責的あるいは自罰的であるに対して、アルツハイマー型認知症では他罰的である。認知症と鑑別される疾患としてのうつ病が併存する場合(図1-1)、うつ状態が先行しその後さまざまな認知機能障害が加わってくる場合(図1-2)もある2)。DLBでは時にうつ状態が先行しその後DLBに特徴的な症状が加わってくることがある。また、認知症の経過の中で抑うつ状態が出現することもある(図1-3)2)。認知症とうつ病との関係は複雑で、診療に苦慮することも多い。
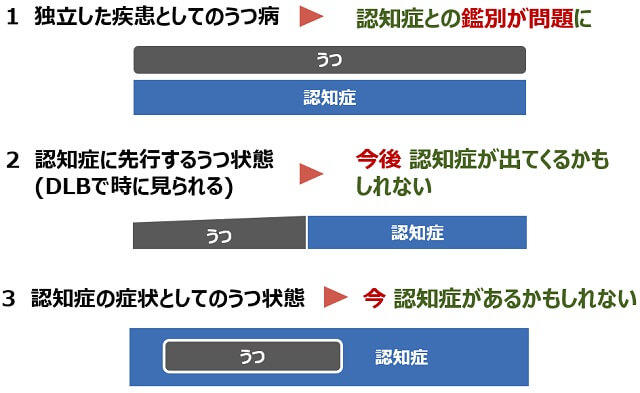
(国立研究開発法人国立長寿医療研究センター編, 20182)より引用)
せん妄とアルツハイマー型認知症の違いを表3に示した2)。記憶、感情、知覚、意欲、思考といった知能は意識の上にのっており、意識の機能が低下すれば知能も低下する。認知症では意識が正常な状態で知能が低下した状態となり、せん妄の本態は意識障害であるため、認知症と区別のつかない知能の障害が出現する。前者は急性でありアルツハイマー型認知症では潜行性に発症し緩徐に進行する。何日の夜からと特定できる発症は前者の特徴である。また、夜間に増悪することが多く夜間せん妄ともいわれる。通常は運動不穏のために多動となることが多いが、多動状態を伴わず不活発な状態となる場合もある。
せん妄の原因は様々で、アルコールや薬物、肺炎や尿路感染症等の感染症、脱水状態や電解質異常、感覚遮断や心理的ストレス(入院、旅行等の環境の変化など)などが多い。せん妄の対処には原因を適切に把握する必要がある。せん妄をきたす可能性のある主要な薬剤では、抗パーキンソン病薬、抗コリン薬、抗不安薬、抗うつ薬などがあるが、頻尿や尿失禁に対して使用される抗コリン薬や胃潰瘍や胃炎に用いられるH2受容体拮抗薬は見逃されやすいので注意を要する1、2)。
| せん妄 | アルツハイマー型認知症 | |
|---|---|---|
| 発症 | 急激 | 緩徐 |
| 日内変動 | 夜間や夕刻に悪化 | 変化に乏しい |
| 初発症状 | 錯覚、幻覚、妄想、興奮 | 記憶力低下 |
| 持続 | 数時間~1週間 | 永続的 |
| 知的能力 | 動揺性 | 変化あり |
| 身体疾患 | あることが多い | 時にあり |
| 環境の関与 | 関与することが多い | 関与ない |
6.認知症の診断プロセス
認知症の臨床診断では、問診、身体的診察、神経学的診察を行い、認知症の有無、症状、重症度を把握する。認知機能検査、脳画像検査、血液検査、脳脊髄液検査などを行い、認知症の病型診断を行う(図2)1)。このプロセスの中で、治療可能な認知症、せん妄、うつ病などの精神疾患、薬剤誘発性認知機能障害を除外する。
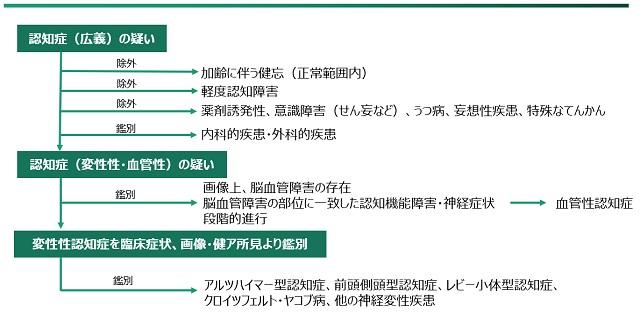
(日本神経学会(監修), 20171)より転載改変)
認知症の診断では問診が最も重要である。認知症の認知機能障害は、時系列で緩徐に進行するため、初期には症状が出揃うことはない。どのような症状から始まったかを詳しく聴取する。認知症ではしばしば本人の自覚がなく介護者からの情報と乖離するため、本人・介護者から別々に問診することは診断のヒントになる。
認知症の診断には「日常の社会生活や対人関係に支障を来たしている」ことが要件である。つまり、ADL自立に関する情報は認知症診断に必須である。ADLは基本的ADL、手段的ADLに分けられるが、早期認知症から手段的ADLが低下する。女性では料理が適切にできているか、男性では買物ができているかを聴くことが有用である。このほか、公共交通機関を使った移動・外出、薬の管理をする、お金の管理をするなどについても確認する2)。
高齢者の認知障害には、薬剤の影響を考える必要があり、服薬内容は必ず確認する。高齢者では、肝・腎機能低下、多剤併用では薬剤性の認知機能低下が生じやすい。特に、抗コリン薬およびベンゾジアゼピン系薬剤は認知機能低下および認知症発症のリスクとなることがある。
内科的診察では、血圧測定、貧血の有無、体温測定を行う。神経学的診察では、利き手を確認する。錐体路徴候、協調運動障害、パーキンソン徴候(振戦、筋強剛、仮面様顔貌、無動、姿勢反射障害)、ミオオクローヌス、嚥下障害、失語、構音障害、歩行障害、排尿障害の有無を診る。
治療可能な認知症を除外するため、血算、血糖、ビタミンB12、葉酸、甲状腺機能、電解質などの測定が推奨されている1、2)。外科的疾患としては、正常圧水頭症、慢性硬膜下出血、脳腫瘍などが代表的であり、必ず頭部CTまたはMRI検査を行う。
7.代表的な認知症疾患の特徴
1.アルツハイマー型認知症
米国精神医学会が2013年に作成したアルツハイマー型認知症の診断基準を図3に示す1、2)。アルツハイマー型認知症(probable)と診断されるためには、2つ以上の認知領域の障害が徐々に進行することが必要である。また、家族歴や家族性アルツハイマー病の原因遺伝子変異が確認されるか、記憶・学習の障害があることが必須である。
- major neurocognitive disorderの基準を満たす
- 少なくとも2つ以上の認知機能の障害が潜行性に出現し、徐々に進行する
- 次のどちらかがあてはまる
- 家族歴か遺伝子検査からAlzheimer's diseaseの原因遺伝子変異が存在する証拠がある
- 下記の全てがあてはまる
- 詳細な病歴や経時的な神経心理検査で、記憶・学習と他の認知機能の低下の明確な証拠がある
- 認知機能が長く安定していることがなく、確実に、徐々に悪化している
- 認知機能障害の原因となりそうな他の神経変性疾患、脳血管疾患、神経/精神/全身疾患や状態がない
- その障害が脳血管疾患、他の神経変性疾患、薬物等の影響、他の精神/神経/全身疾患によるものとして説明できない。
図3 DSM-5(米国精神医学会診断統計便覧第5版)によるアルツハイマー型認知症の診断基準
(国立研究開発法人国立長寿医療研究センター編, 20182)より引用)
アルツハイマー型認知症の人の脳では老人斑と神経原線維変化を認めることが特徴である。従来、用語としてアルツハイマー病とアルツハイマー型認知症はほぼ同義として扱われてきた。近年PETや脳脊髄液検査により、臨床症状が出現していない時期から脳内のアルツハイマー病変化がとらえられるようになってきた。いずれアルツハイマー型認知症に移行するが、臨床症状のない時期を前臨床期アルツハイマー病(preclinical AD)と表現し、脳内にアルツハイマー病変化がおこり、軽度認知障害の時期(ADによる軽度認知障害:MCI due to AD)をへて認知症を発症する全病期をアルツハイマー病とよび、認知症を発症してからをアルツハイマー型認知症とよぶという考え方が提唱されている(図4)2)。今後バイオマーカーの進歩により、レビー小体型認知症や前頭側頭型認知症にも同様の用語区分が生じる可能性がある2)。
アルツハイマー病では脳脊髄液中のアミロイドβ42の低下、総タウ、リン酸化タウの上昇を認める6、7)。脳脊髄液中のAβ42の低下は脳内Aβ蓄積を反映すると考えられており、アミロイドPETの結果とよく相関する8)。リン酸化タウの測定は認知症の補助診断を目的とした検査として保険適応となっている。またアルツハイマー型認知症にコンバートする軽度認知症者は、Aβ42の低下、総タウ、リン酸化タウの上昇を認めることが報告されている。
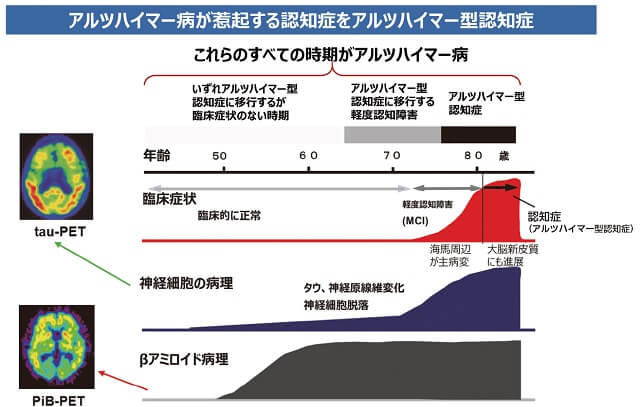
(国立研究開発法人国立長寿医療研究センター編, 20182)より引用)
2.血管性認知症
血管性認知症の診断基準としてDSM-5の血管性認知症の診断基準の要旨を図5に示した1、2)。major neurocognitive disorderと脳血管障害が存在し、その両者が時間的に関連している、或いは血管性認知症に多くみられる複雑性注意と実行機能の障害が明らかであることが要件である。従来の診断基準では特異度は高い反面、感度が低く、血管性危険因子の管理が必要な認知症を見逃す危険性が指摘されていた。新たな診断基準によってこのような課題の改善が期待される2)。
図5 DSM-5(米国精神医学会診断統計便覧第5版)による血管性認知症の診断基準
(国立研究開発法人国立長寿医療研究センター編, 20182)より引用)
近年、血管性認知症の考え方の変化がある。アルツハイマー型認知症と血管性認知症は本来異なる疾患であり、両者の併存は混合型認知症ととらえられていた。しかし実際には高齢者では、様々な程度に脳血管障害が合併しており、長い経過を呈するアルツハイマー型認知症の経過のなかで脳血管障害を合併する例(AD+CVD)は多い(図6)9)。
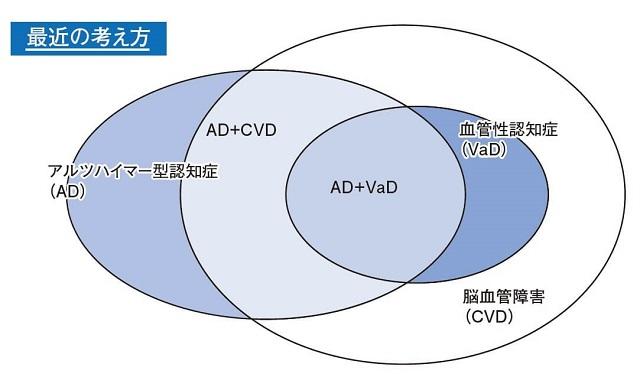
(国立研究開発法人国立長寿医療研究センター編, 20182)より引用)
3.レビー小体型認知症
レビー小体型認知症の診断基準は、2017年に国際ワークショップがレビー小体型認知症の臨床診断基準第4版を公表した(図7)1、2、10)。この診断基準では、2つ以上の中核的臨床的特徴が存在するか、1つの中核的臨床的特徴が存在し、1つ以上の指標的バイオマーカーが存在する場合、Probable DLBと診断される。変動する認知障害、パーキンソニズム、繰り返す具体的な幻視に加えて、レム期睡眠行動異常症、SPECTあるいはPET イメージングによって占めされる大脳基底核でのドパミントランスポーター取り込み低下があげられている。
レビー小体型認知症では、病初期に記憶障害が目立たない場合もあり、記憶障害以外に注意障害、遂行障害、視空間障害などの有無を検討することが大切である。アルツハイマー型認知症の早期との比較では、レム期睡眠行動異常症以外にも、パーキンソニズム、歩行障害、自律神経症状、嗅覚障害、幻肢、せん妄、睡眠障害や精神症状などが多いことが報告されている1、2)。
図7 レビー小体型認知症の診断基準
(国立研究開発法人国立長寿医療研究センター編、20182)より引用)
4.前頭側頭型認知症
2011年に提唱された診断基準では、異常行動を中心とする行動障害型前頭側頭型認知症(behavioural variant FTD:bvFTD)と言語障害を主体とする言語障害型前頭側頭型認知症に分類される(図8)1、2、11)。行動の脱抑制は社会的に不適切な行動や礼節や礼儀の欠如、衝動的で不注意な行動といった形で現れる。無関心無気力は自発性の低下としてあらわれるが、一方でDのような常同的行動は執拗に繰り返すといった二面性を有する。共感、感情移入の低下は他人の気持ちを察することができない。アルツハイマー型認知症でとりつくろいがみられるのと対照的に他人からどのようにみられているかという視点を持てない。Dは決まったコースを歩き続ける、一日の日程が固定されそれを繰り返す(時刻表的生活)がみられる。Eは異常な食欲亢進や甘いものを大量に食べるといった形であらわれる。進行すると異食がみられることがある。Fは実行障害が強い割にエピソード記憶や視空間機能が保たれるという意味で、エピソード記憶障害がおこらないということではない。
A~F項目のうち3つを認めればbvFTD疑いであり、さらに臨床的確診のA、B、C3項目すべてを満たせば臨床的確診となる。これ以外の症状として、被影響性の亢進(検者のまねをしないでと説明してもまねしてしまう模倣行動や、目に映る文字をすべて読み上げてしまう、脅迫的音読など)も重要である2)。
前提:観察または病歴から行動及び/または認知機能の進行性の悪化を認めること
図8 行動障害型 前頭側頭型認知症の診断基準(bvFTD)
(国立研究開発法人国立長寿医療研究センター編, 20182)より引用)
8.認知症の包括的診療を考えて
前述のように、アルツハイマー病では、前臨床期、MCIを経て、アルツハイマー型認知症に進展すると考えられている。病期により本人・介護者の抱える問題点も異なる。私どもは、MCIからBPSDや歩行障害、栄養障害が生じていること、また、BPSD、ADL低下、身体疾患が相まって介護負担の原因となることを明らかにしてきた12、13、14)。認知症の治療では、薬物療法に加え、ADL維持を目的とした認知リハビリテーション、介護負担の軽減のための家族教室、看護相談を行っている。認知症診療では、家族への配慮が重要であることは言うまでもない。介護者に関するアセスメントも必要である。薬物治療だけではなく、認知症の当事者(本人・介護者)を多職種チームで支えることを、認知症の包括的診療と呼んでいる。
MCIと診断された高齢者にも、MCIの正しい知識を伝えること、本人の希望に応じて治験や様々な臨床研究への参加を促している。MCI患者は認知症に対する大きな不安を持っており、「認知症疾患診療ガイドライン2017」にもあるように、生活習慣病の適正な管理、運動などのライフスタイルの指導を積極的に行う。認知症リスクとして、糖尿病、高血圧、運動不足、栄養障害、社会孤立、睡眠障害などがあり、運動、多様性のある食事、活動的な社会生活の効果が期待されている。表4には認知症の包括的診療を考え、評価すべきことをまとめた(神経心理検査の詳細は他稿を参照していただきたい)。
| 項目 | 尺度 |
|---|---|
| 認知機能* (スクリーニング) |
ミニメンタルテスト・改訂 長谷川式簡易知能評価スケール MoCA-J *神経心理検査の詳細は4.認知機能検査を参照 |
| 重症度 | Clinical Dementia Rating (CDR) Functional Assessment Staging(FAST) DASC-21 |
| 生活機能 | 手段的ADL:Lawton index 基本的ADL:Barthel index |
| BPSD | Neuropsychiatric Inventory(NPI) 認知症行動傷害尺度(Dementia Behavior Disturbance Scale:DBD) |
| 介護負担 | Zarit介護負担尺度日本語版 |
| 身体疾患 | 糖尿病、高血圧、肥満とやせ、聴力・視力など |
| ライフスタイル | 転倒歴、歩行能力(歩行速度、握力、体組成)、睡眠、栄養評価 |
| 社会・経済的環境 | 生活様式、独居・婚姻、社会活動など |
9.まとめ
今後、認知症疾患のバイオマーカーの開発が進むと、脳の病態に基づいた認知症診断が可能になることが予想される。前臨床期、MCIから認知症において、認知障害を連続的に予防し高齢者を支えていく医療が可能かもしれない。認知症の包括的診療を発展させるためには、もの忘れ外来と地域連携をスムースに行うことが必要である。多職種で地域連携の課題を科学的に解析し、診断後支援を効率的に行いたい。
文献
プロフィール

- 櫻井 孝(さくらい たかし)
- 国立長寿医療研究センター もの忘れセンター長
- 最終学歴
- 1992年 神戸大学大学院修了(医学博士)
- 主な職歴
- 1992年 岡崎国立共同研究機構生理学研究所研究員 1993年 米国ワシントン大学薬理学教室研究員 2001年 神戸大学大学院医学系研究科老年内科助手 2007年 神戸大学付属病院老年内科講師 2010年 国立長寿医療研究センター・もの忘れセンター部長 2014年 同・センター長 2016年 名古屋大学大学院医学系研究科認知機能科学分野・連携教授
- 専門分野
- 認知症、糖尿病、老年医学
※筆者の所属・役職は執筆当時のもの
