第3章 認知症の診断 3.アルツハイマー病の血液バイオマーカー
公開月:2019年10月
国立長寿医療研究センター研究所 所長
柳澤 勝彦
1.はじめに
高齢者人口の増加とあいまってアルツハイマー病患者数も増え続け、団塊世代がアルツハイマー病好発年齢となる2025年までに予防法や治療法開発の道筋をつけなければならないとの危機感が広まっている。アルツハイマー病の確定診断は現在においても剖検病理に依拠するものの、脳の画像診断法や、脳脊髄液、さらに最近では血液の免疫生化学的解析あるいは質量分析が著しく進歩し、我々のアルツハイマー病に対する理解を大きく変えつつある。なかでも、アルツハイマー病脳内に形成される老人斑の成分であるアミロイド[アミロイドβ(Aβ)蛋白が異常に重合した構造物]と特異的に結合し、陽電子放射断層撮影(PET)でこれを描出する技術(アミロイド・イメージング)が開発されたことが契機となった。加えて、脳脊髄液中のAβやタウ(老人斑と並んでアルツハイマー病の代表的な病理所見である神経原線維変化を構成する神経細胞内蛋白)の測定情報が総合的に検討され、脳内ではアルツハイマー病の発症(認知症の出現)よりも20年ないしは30年前にすでにアミロイドの蓄積が始まっていることが明らかにされた。この知見はこれまでのアミロイド仮説にさらなる支持を与えることとなり、アミロイドの蓄積を開始点とする病理学的変化、即ち、シナプスの機能障害/脱落、神経原線維変化の形成、神経細胞を捕捉するバイオマーカー(本項では脳画像情報も広義の意味でバイオマーカーとして論じる)の開発が近年活発に進められている。一方で、10年以上に渡り、製薬企業やアカデミアの研究者は、症状の緩和だけではなく、アルツハイマー病の発症や進行を抑えうる、治療薬や予防薬(これらはアルツハイマー病という疾患の進行過程を変化/修飾しうるという意味で疾患修飾薬と呼ばれる)の開発を精力的に進めている。しかし残念ながら、疾患修飾薬としての期待に応えうる薬はただの一つも開発されていない。失敗が相次ぐ真の理由は不明であるが、最も考えられる理由は、臨床試験における介入の時期が遅すぎた可能性である。これまで開発が失敗に終わった多くの治験薬はアミロイドを標的としていたにもかかわらず、介入開始時期は発症後であった。上述のように、アルツハイマー病はアミロイドの蓄積から20年以上の時間を経て発症に至り、この間にアミロイドを契機としつつもアミロイドに依存しない病理的な変化が層状的に脳内では形成されていると考えられ、発症時にはすでにこれらのアミロイド非依存性の病態が主体となっている可能性が考えられる。従って、今後、真に有効な薬を開発するためには、発症早期あるいは発症前に治験薬の投与を開始すべきであり、そのためにはアルツハイマー病脳病変の存在を正確に捕捉する検出法の開発が必須である。本稿においては、アルツハイマー病のバイオマーカーのなかで血液を対象とする研究開発の進捗を紹介し、今後の課題と可能性を展望したい。
2.アルツハイマー病 バイオマーカー開発の経緯
1.脳脊髄液検査
脳脊髄液と脳実質とは上衣細胞が形成する脳脊髄液脳関門により境されている。これにより物質の移動は制限されるものの、血液脳関門に比べ、その程度は緩く、血液以上に脳脊髄液は脳実質の情報を多く有している。アルツハイマー病の病態との関係での脳脊髄液研究においては我が国の研究者が先駆的役割を果たした1、2)。これらの研究によりアルツハイマー病患者の脳脊髄液中のAβ42(老人斑アミロイドの主要構成成分であるAβ分子種)濃度の低下が確認され、アルツハイマー病診断に有用なバイオマーカーになる可能性が示された。その後、脳脊髄液中のAβ42の減少はアルツハイマー病の前駆状態(軽度認知機能障害)を含め発症前にすでに観察されることが報告された3、4)。Aβ42の減少に加え、tau(特にリン酸化tau)の増加がアルツハイマー病脳脊髄液で観察され、Aβ42の変化と兼ね合わせることで診断的価値が増大するとされた(その後の研究で、tau全量の増加はアルツハイマー病以外の神経細胞傷害でも観察され、リン酸化tauの増加はアルツハイマー病に特異的と理解されている)。
2.PETイメージング検査
アルツハイマー病脳内に蓄積するアミロイドをPETによって描出する技術の開発は、アルツハイマー病の基礎から臨床にわたる研究を大きく発展させた5)。これらのPET用化合物のうち[C-11]標識のPIBは[F-18]標識化合物に比べ、アミロイドへの結合特異性が高く優れた性質を有するが半減期が短く、これを用いた検査が行える施設はサイクロトロンや標識化合物の調製装置を備えている必要があり、一回の検査費用も数十万と高額である。最近ではtau蓄積やシナプス脱落を検出するPETイメージングの開発も盛んである。
3.血液バイオマーカーが求められた理由
脳脊髄液検査やPETイメージング検査はアルツハイマー病の脳内変化を高い精度で検出する技術であり、アルツハイマー病治療薬開発への大きな貢献が期待されている。しかしながら、前者は侵襲性の高い検査であり、とりわけ高齢者での実施には被検者の身体的負担が大きい。一方、後者は上述したように費用が高額である。大規模な治験への参加者の選別にはいずれも不適であると言わざるを得ない。このような状況において、期待が寄せられたのが血液バイオマーカーの開発であった。
3.脳内アミロイドを検出する 血液バイオマーカー
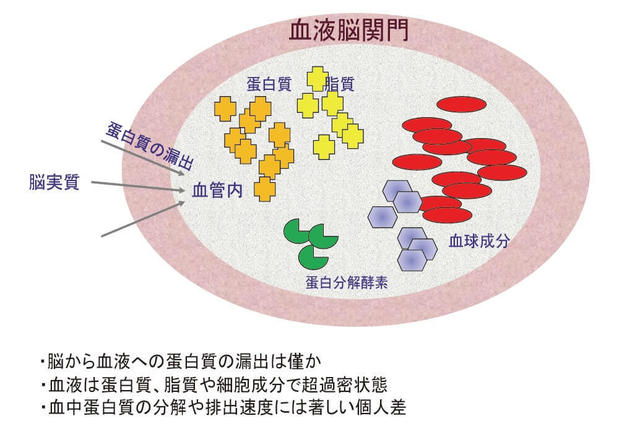
1.血液バイオマーカー開発の阻害要因(図1)
採取が容易な血液で脳内病変を正確に検出することは研究者の長年の夢であった。Aβが発見され、良質の抗Aβ抗体が作製されてまもなく、ヒトの末梢血内でAβが検出され、アルツハイマー病患者と対照者との間で比較がなされたが、その段階では有意な違いは認められなかった6)。このような状況は最近まで変わらず、血液バイオマーカーの開発は困難をきわめた7、8、9)。血液検査で脳内病変を捉えることが困難な第一の理由は、血液脳関門の存在である。脳を保護し、生理的に脳の恒常性を維持する上で重要な血液脳関門であるが、脳内病変を血液で検出する上では大きな障害となる。脳の細胞外液中蛋白の血液脳関門の通過率はおよそ1%とされている。第二の理由は、多種多様の蛋白、脂質、細胞が超過密な状態で混在する血液にわずかに脳から漏出した蛋白を正確に検出することの困難さにある。加えて、第三の理由は、脳から血液に漏出した蛋白は血液内に存在する蛋白分解酵素により処理されるが、その分解活性には個人差が大きいと考えられる点である。例えば、肺炎等の何らかの感染症や炎症性疾患に罹患している個人においては血液中の蛋白分解酵素活性は非特異的に上昇している可能性が高い。すなわち、脳の病態とは連関しない、個々人に特異的な全身性要因によって、脳から漏出した蛋白の血液内濃度は修飾されることになる。
2.血液バイオマーカー開発成功の要因
我々はPETイメージングでのアミロイド検出に匹敵するアルツハイマー病血液バイオマーカーの開発に世界で初めて成功した10)。成功を収めることができた最大の要因は、Aβ検出の根幹をなす質量分析技術の高さにある。これは2002年にノーベル化学賞を受賞した共同研究者の田中耕一氏(島津製作所)が開発した技術であり、従来の抗体を用いたAβ検出法(ELISA)では不可能であった、多種類のAβおよびAβ関連ペプチドの正確な同時検出を可能とするものであった。Aβの主要な分子種はAβ1-40とAβ1-42であり、このうち脳内ではAβ1-42が選択的に重合しアミロイドを形成することが知られている。今回の我々の方法においては、Aβ1-42ないしはAβ1-40のみならず、新たに田中らによって発見されたAPP669-711も測定され、さらにこれらの量比に注目したことにより、上記の阻害要因の関与が縮減され、脳内のAβ1-42の重合動態の観測が初めて可能となった(図2)。その後、本血液バイオマーカーについて、その脳内アミロイド蓄積の予測精度を検証するため、解析試料数を増大させ、国内ならびに国際共同研究を実施し、第一報での結果を検証することができた11)。
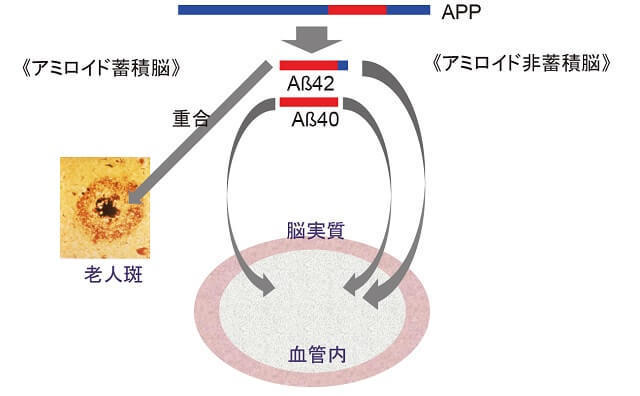
脳内で産生されたAβ42とAβ40の血管への漏出の程度は、Aβ42の脳実質内での重合により大きく変動する。
3.世界的な開発の進捗
2014年の我々の質量分析による血液バイオマーカー開発の成功の後、2017年、米国のグループが同様の方法により脳内アミロイド蓄積を予測しうる血液バイマーカーの開発を報告している12)。さらに2017年から2018年にかけて、高感度のELISAを駆使し、Aβ分子種の量比に基づく血液バイオマーカーの報告が相次ぎ、PETイメージングと検出感度において肩を並べる域に達しつつある13、14)。これらを受けて、2018年に米国シカゴ市で開催された、Alzheimer's Aβociation International Conference(AAIC)ではアミロイド検出の血液バイマーカー開発の今後の課題について活発な議論が行われた。以上の血液中のAβ濃度の変動と脳内アミロイド蓄積との量的関係の議論に加えて、最近、Aβの血液中の二次構造の変化をimmuno-infrared-sensorで解析する方法が開発され、アルツハイマー病発症早期の段階での変化が捉えられる可能性も報告されている15)。
4.早急に検討すべき課題
血液バイオマーカーに限らず、脳脊髄液バイオマーカーにおいても、生体試料を採取してから解析に供するまでの調製ならびに解析自体の手順を如何に統一するかが今後重要な課題になると考えられる。アルツハイマー病の患者数は世界で4,000万人を超えており、その数は今後ますます増大することが予想される。それらに対応するべく、世界の多くの解析拠点で同一の操作がなされ、共通のカットオフ値で陽性と陰性の判別がなされることが、アルツハイマー病の基礎研究にも、治療薬/予防薬開発にも重要になる。しかし、解析技術の世界的な統一は容易ではなく、血液バイマーカーよりも約20年研究開発が先行している脳脊髄液バイオマーカーでも、これらの課題は未だ解決されていない。
4.アミロイド以外を標的とする 血液バイオマーカーの開発
1. tau
老人斑と並んでアルツハイマー病の主要な病理変化である神経原線維変化の構成成分であるtauについても血液を対象とする研究が進められている。しかしながら、Aβ同様、tauの病的動態を血液中で正しく捕捉することは容易ではなかった。最近、極めて高感度の免疫学的検出法が開発され、加えて、特異な位置がリン酸化されているtauを標的とすることにより、tau血液バイオマーカーの開発がにわかに進展し始めた16、17)。
2. 脳内炎症
老人斑と神経原線維変化はアルツハイマー病の二大病理であるが、これらの病変がどのようにして認知機能障害の基盤となるシナプス障害や神経細胞脱落を誘導するかは依然未解明である。これに関して、近年、中枢神経系に特異な炎症(neuroinflammation)に研究者の注目が集まっている。最近、炎症性の指標として以前より注目されている血液中のインターロイキンのうちIL-8が脳脊髄液中のリン酸化tau値と相関する可能性が報告され18)、今後、血液中のAβやtauと同時に炎症性のマーカーを測定することで脳内のアルツハイマー病病変の進行が総体的に追跡できる可能性が出てきた。
3.神経細胞変性
神経細胞がアルツハイマー病の進行に伴い変性、脱落する過程を、脳萎縮の評価軸を超えて、神経細胞単位で定量的に解析する技術の開発は、今後の様々な治療法の開発にとって重要である。これまで神経細胞を構成する骨格蛋白の一つである、ニューロフィラメントを対象に研究がなされてきたが、必ずしも十分な結果は得られていなかった。最近、他のマーカー開発にも応用されている高感度の免疫学的検出法を適用した詳細な解析が行われ、その結果、ニューロフィラメントの一部(neurofilament light)は脳萎縮や認知機能低下の進行と高い相関をなすことが報告された19)。ニューロフィラメントの細胞外への漏出は、アルツハイマー病以外でも生じる非特異的現象であるが、他のバイオマーカーと同時に解析することで、アルツハイマー病に伴う神経細胞変性を定量的に、また経時的に評価できる意義は大きいと言える。
4.その他
これまで紹介してきた様々な血液バイオマーカーはいずれも形態学的なあるいは生物学的な変化を客観的に捉えたものといえる。興味深いことに、アルツハイマー病の神経病理学的変化が相当程度進んだ状態においても認知機能が保たれることが知られており、無症候性アルツハイマー病と呼ばれる。従って、神経病理学的変化の評価と同時に、脳機能、特に認知機能の障害程度を評価あるいは予測することができれば、今後の発症予防の介入方法の開発には有用であると期待される。この領域の研究はまだまだ緒についたばかりであるが、最近、ある種のシグナル伝達物質[insulin-like growth factor(IGF)-1やIGF-binding protein(IGFBP)-3)、あるいはそれら量比]が認知機能低下を予測しうる可能性が報告され、注目されている20)。
5.血液バイオマーカーの有用性についての展望と課題
1.治療薬/予防薬開発への貢献
これまで、数多くのアルツハイマー病の疾患修飾薬の開発が試みられてきたが、残念ながらそのほとんどが失敗に終わっている。成功に至らない理由は上述のごとく、介入の時期が遅過ぎたことと治験対象者にアルツハイマー病以外の原因による認知症患者が混在していたことであろう。これらの問題の解決には、簡便で廉価なバイオマーカーが必須であるが、本稿で紹介した血液バイマーカーはこの点で大きな貢献をするものと期待される。当面の間は、PETイメージング検査でのアミロイド蓄積を確認する必要があると思われるが、高額なPETイメージング検査の前の絞り込み(プレスクリーニング)を血液バイオマーカーで実施できれば大幅な開発費用の削減になり、結果的に、治療薬/予防薬の開発が加速されることが期待される。
2.アルツハイマー病の新しい捉え方
様々なバイオマーカー研究の進展の結果、アルツハイマー病は脳内病変の出現から長い発症前期を経て、臨床的に問題となる認知症に至ることが明らかになった。即ち、発症が80歳であれば、50歳台あるいは60歳台に脳病変がすでに存在し進行しており、この長い発症前期に、発症を阻止する予防的介入(薬物であれ非薬物であれ)を実施することが決定的に重要になってくる。これらの理解の基に、最近、アルツハイマー病の定義を見直す動きが見られ、またアルツハイマー病治療/予防薬治験の承認基準も症状の緩和に依拠することなく、客観的なバイオマーカーの変化を基礎とする方向に大きく遷移しつつある21)。このように症状ではなく客観的な検査の所見に基づく治療(先制治療)や予防は、生活習慣病や癌の臨床現場ではすでに行われている医療であり、漸く、アルツハイマー病もその域に達したといえる。換言すれば、アルツハイマー病は中年期の疾患であるとの認識がいずれ定着するであろう。
3.倫理的課題
最後に倫理的課題について触れておきたい。アルツハイマー病の脳病変の存在を血液検査で捕捉できることは素晴らしいことである。しかし、残念ながら、アルツハイマー病の脳病変を捉えたとしても、その進行を止め、発症を遅延ないしは阻止できる医学的な介入方法は未だ開発されていない。これまでの脳脊髄液検査やPETイメージング検査は、それぞれ侵襲性があり、高額であることが「壁」となって、これらの検査が広く一般化することを妨げたと言える。しかし、血液バイオマーカーの開発成功はこの「壁」を崩壊させた。発症前の被検者へのPETイメージング検査等の結果告知については、その是非がすでに議論されている22、23)。安易に血液バイオマーカー検査を実施することは倫理的な問題を孕んでいることに注意したい。
文献
プロフィール

- 柳澤 勝彦(やなぎさわ かつひこ)
- 国立長寿医療研究センター研究所 所長
- 最終学歴
- 1980年 新潟大学医学部医学科卒
- 主な職歴
- 1984年米国国立衛生研究所研究員以後、新潟大学脳研究所神経内科助手、東京医科歯科大学医学部神経内科助手、東京大学医学部脳研究施設病理学部門助手、国立長寿医療センター研究所部長を経て2005年 国立長寿医療研究センター研究所 副所長 2010年 国立長寿医療研究センター認知症先進医療開発センター センター長(併任) 2015年 国立長寿医療研究センター研究所 所長 現在に至る
- 専門分野
- 分子神経病理学、特にアルツハイマー病の発症機構に関する研究、アミロイドβ蛋白質の脳内重合開始機構に関する研究
※筆者の所属・役職は執筆当時のもの
