第4章 認知症の予防 2.生活習慣病 (1)糖尿病
公開月:2019年10月
東京医科大学高齢総合医学分野(高齢診療科) 主任教授
認知症疾患医療センター センター長
羽生 春夫
1.はじめに
現在、我が国の平均寿命は男性が81.09歳、女性が87.26歳と世界のトップレベルにあるが、介護を要しない自立可能な健康寿命はそれぞれ72.14歳、74.79歳と約9~12年短い。この期間、何らかの生活障害から要介護となってしまう。その原因として第一位に認知症が挙げられ、今後超高齢者が増加していく中で人生ラスト10年問題として、認知症対策が最も重要な課題となっていくだろう。
認知症のうち過半数を占めるアルツハイマー病(Alzheimer disease:AD)については、病態解明に関する基礎研究は着実に進んでいるが、まだその根本治療薬は登場していない。一方、生活習慣または生活習慣病が、血管性認知症(vascular dementia:VaD)のみならず、ADの発症や進展にも深く関係していることが知られるようになってきた。特に、2型糖尿病と認知症またはADとの関連については、多くのエビデンスが集積されつつある。
本稿では、初めに糖尿病による認知症の発症リスクや病理学的背景の多様性について述べ、次いで糖尿病性認知症の臨床と病態、治療やケアについて筆者らの得たデータを含めて解説し、糖尿病という観点から認知症予防が期待できる可能性について概説したい。
2.糖尿病による認知症の発症リスク
これまでの多くの疫学研究で、糖尿病と認知症の間には密接な関連のあることが報告されてきた。最近のシステマティックレビューでは、糖尿病による全認知症の発症リスクはハザード比で1.7倍、ADは1.6倍、VaDは2.2倍となることが示された。さらに最近、我が国では久山町の縦断調査をもとに認知症有病率の将来推計が報告されたが、糖尿病の有病率が20%上昇すると2025年には認知症者が675万人から730万人へと増加することも示されている1)。このことは、糖尿病や耐糖能異常の適切な治療や管理が、認知症の予防や治療に大きな役割を果たす可能性を示唆している。
3.糖尿病による認知症の病理学的背景の多様性
多くの基礎研究から、糖尿病に伴うインスリンシグナル伝達の障害やインスリン抵抗性が、アミロイドβ(Aβ)やタウのリン酸化を介してAD病理を促進するというメカニズムが報告されている2)。実際、糖尿病またはインスリン抵抗性が、Aβを含む老人斑や神経原線維変化の出現を促進しているという報告もある。しかし、多くのヒトを対象とした病理学的研究では糖尿病患者やインスリン抵抗性を示してもアミロイド斑や神経原線維変化は必ずしも増加しておらず、むしろ一部の研究ではAD病理変化は非糖尿病患者と比べて少ないとする報告もみられる。しかし、検討された報告の多くで、脳血管性病変、特に小梗塞の合併は明らかに増加している。これまでの病理学的研究報告を表1にまとめて示す1)。
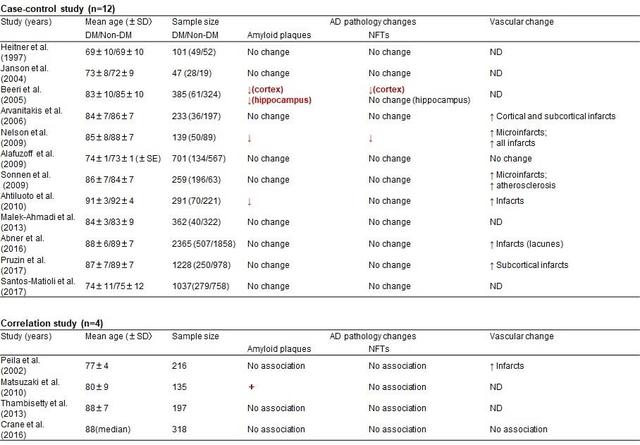
このような疫学研究と病理学的研究の結果には乖離があるようにもみえるが、これをどのように理解すべきか?ここで、米国で行われた有名なNun研究を思い出してみたい。Nun研究とは修道女を対象とした縦断的研究であるが、その中で剖検において、ADと比べて脳血管性病変(cerebrovascular disease:CVD)を合併したADでは、より軽度のAD病変(神経原線維変化の程度で評価)でもMini-Mental State Examination(MMSE)で示された認知機能障害はより重度であったと報告されている。これはAD病理にCVD病変が加わり脳障害の総和の結果として、認知症がより重症になったことを示している。
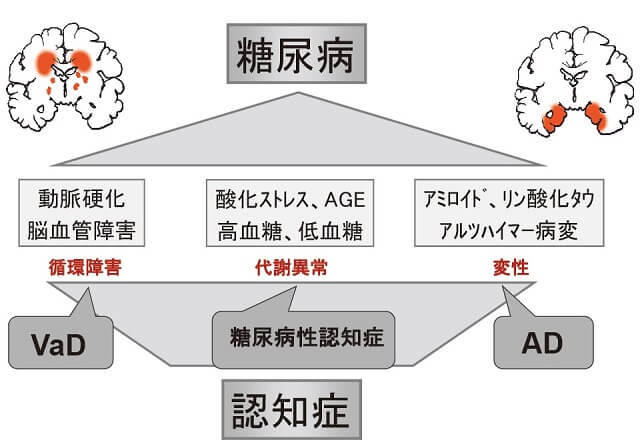
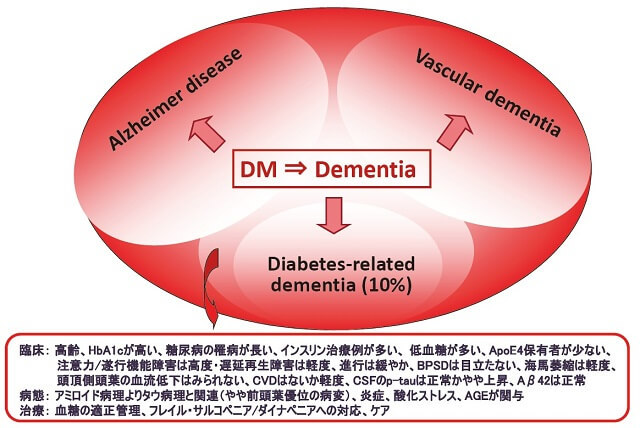
糖尿病においては、脳内に動脈硬化やCVDなどの血管病変に加えて、糖毒性や酸化ストレス、終末糖化産物などによる代謝性病変が加わる。すなわち、インスリン抵抗性やインスリンシグナル伝達の障害によるAD病理過程の促進に加えて、循環障害や代謝異常が加わり、"合わせ技"として認知症の発症を早めているものと推察される(図1)2)。糖尿病と関連した認知症の多くはADやVaDと考えられているが、高齢者では種々の病変からなる複合病理を示すことが多い。その中でも血管性病変が優位となるか(VaDに相当する)、変性が優位となるか(ADに相当する)によって治療や対応は異なってくる。そして、AD病理や血管性病変よりも糖代謝異常に伴う神経障害が認知症の発症に深く関わっている一群があり、我々はこれを"糖尿病性認知症(diabetes-related dementia:DrD)"と呼んでいる3)。本症は糖尿病による最も典型的な認知症病型であり、血糖管理による治療や予防が期待される一群である。
4.糖尿病性認知症の臨床、病態、治療、ケア
1.臨床像
本症の多くは臨床的にADと診断されていることが多いが、①やや高齢である、②HbA1cが高い、③インスリン治療例が多い、④糖尿病の罹病期間が長い、⑤ApoE4保有者の頻度が少ない、⑥大脳萎縮は明らかだが、海馬の萎縮が軽度である、⑦注意力や遂行機能の障害が高度であるが、遅延再生の障害が軽度である、⑧進行が緩やかである、という臨床的特徴がみられる3)。スクリーニング法としても、MMSEより前頭葉の遂行機能や注意を評価できるMoCA(Montreal Cognitive Assessment)の方が本症の検出には有用である。MRIで血管性病変はみられないか、あってもわずかであり、SPECT(single photon emission CT)でもADに特徴的な頭頂側頭葉の血流低下は認められないことが多い。脳血流SPECTによる3年間の縦断的な血流変化をみると、やや前頭葉優位の血流低下が緩やかに進展していくが、ADにみられるような頭頂側頭葉の血流低下を示すことは少ない4)。
2.背景病理
これまで、本症に特異的な病理組織学的変化は確認されていない。概して、アミロイド班や神経原線維変化は種々の程度にみられるが、ADのように広範かつ高度な所見はみられにくいようである。
脳脊髄液検査では、リン酸化タウはほぼ正常か軽度上昇を示すのみだが、Aβ42蛋白の低値は認められないことが多く、ADの特徴的な所見とは異なる。
PiBを用いたPET(positron emission tomography)によって、脳内アミロイド集積の頻度をみると、陽性率はせいぜい30-40%程度であり、これは70~80歳代の認知機能の正常な健常老年者の陽性率と比べても決して高くはない。一方、PBB3を用いたPETによってタウの集積をみると多くは陽性となった(75%前後)。さらにPiBとPBB3 PETを同時に施行した糖尿病性認知症患者の集積パターンを分類すると、一部PiB陽性/PBB3陽性(AD病理)もみられたが、多くはPiB陰性/PBB3陽性(タウオパチー)で、その他にはPiB陰性/PBB3陰性(非特異的な神経細胞障害)もみられた5)。したがって、本症の背景病理の多くはタウオパシーであるが、一部AD病理や糖毒性と関連したアミロイドやタウを介さない非特異的神経細胞障害から構成されていると考えられた。
最近、糖尿病(diabetes mellitus:DM)に伴うインスリンシグナル伝達の障害やインスリン抵抗性がアミロイド病理よりもタウ病理の発現を促進するという研究報告は、基礎的にも臨床的にも増えてきており、この点に関して我々のアミロイド/タウPET所見とも矛盾はしない。
以上から考察すると、DMによってCVDやAD病理が発現しやすくなり、それぞれVaDやADという認知症を発症していくが、CVDもAD病理も免れた高齢者がその後加齢に伴うタウ病理がコントロール不良なDMまたはインスリン代謝異常によって加速され認知機能の低下をきたすようになったのが本症の病態ではないかと考えている。
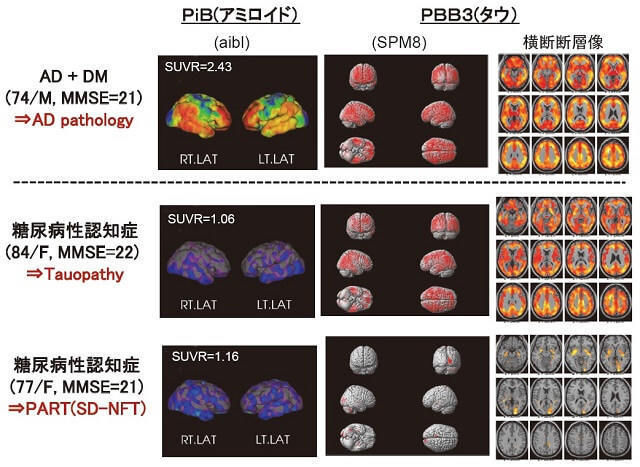
上段はPiB陽性、PBB3陽性で、AD病理を反映する。中段はPiB陰性、PBB3陽性(側頭葉内側から広範な大脳皮質)でタウオパチーを反映する。下段はPiB陰性、PBB3陽性(側頭葉内側に限局)で原発性年齢関連タウオパチー(PART)または神経原線維変化型老年期認知症(SD-NFT)に一致する。
3.病態
ADと比較して、糖尿病性認知症では有意なIL-6の高値、TNF-αや高感度CRPの上昇傾向がみられ、さらにIL-6とMMSEとの間には有意な負の相関が認められた2)。
ADやDMを合併したADと比べても糖尿病性認知症ではDNAの酸化的損傷度を反映する尿中8-OHdGの有意な上昇がみられ、膜リン脂質の酸化ストレスマーカーとしての尿中8-イソプロスタンの上昇がみられた。一方、内因性抗酸化物質として知られる血中のアルブミン値や間接ビリルビン値は有意に低く、これらの一部はMMSEとの相関もみられたことから、末梢レベルでも酸化ストレスの異常が認知機能障害に関与している可能性が示唆される2)。
終末糖化産物の一つであるカルボキシメチルリジンはADやDMを合併したADと比較して糖尿病性認知症では有意な高値を示した2)。
糖尿病に伴う血管内皮の障害から、血液脳関門の透過性が亢進し、炎症、酸化ストレスの亢進などが神経細胞障害に働く可能性は高いと考えられる。
4.診断のためのガイドライン
前述したような臨床像や検査所見を考慮して、本症の診断のためのガイドラインを表2に示す6)。本症は特定の背景病理に起因するのではなく、表に示されたような所見に特徴づけられる一臨床単位と考えられる。
表2 糖尿病性認知症の臨床診断のためのガイドライン
- 2型糖尿病:経過は長くコントロールは不良
- 認知症:記憶障害より注意・集中力や遂行機能障害が目立ち、進行は緩徐
- CT/MRI:血管性病変や白質病変は軽微で、大脳萎縮はみられるが海馬領域の萎縮は軽度
- SPECT/PET:大脳後方連合野の血流/代謝の低下を認めないことが多い
- 脳脊髄液:リン酸化タウは正常か軽度上昇し、Aβ42の低下はみられない
- アミロイド/タウPET:アミロイドは陰性で、タウは陽性のことが多い
- アポリポ蛋白E(ApoE)遺伝子多型:ApoE4キャリアは少ない
- 除外基準:甲状腺機能低下症、ビタミンB1, B12低下症、アルコール中毒、頭部外傷、血管性認知症、その他の認知症
特定の背景病理に起因するのではなく、上記所見に特徴づけられる一臨床単位
5.治療
一般に、空腹時血糖値よりも食後の高血糖や血糖の日内変動が認知症の発症リスクとなりやすい。HbA1cが7.0%を超えると認知症の発症リスクが高くなり、逆に低血糖発作を数回起こした場合は起こさなかった場合と比べて認知症の発症頻度も2倍近く高くなることが示されている。認知症患者の血糖管理については一定のコンセンサスは得られていないが、高齢糖尿病患者の血糖コントロール目標値に関しては、日本糖尿病学会と日本老年医学会からの合同委員会案が発表されている。認知症の有無や程度に加えて、併発疾患、基本的または手段的ADL、フレイル、重症低血糖のリスクなどを考慮して個別に設定するよう勧められている。
糖尿病を伴う認知症患者においては、種々の病態が混在していることが多く、背景にある病理・病態によって治療やケアは異なってくる。AD病理が優位となるときは抗認知症薬を、血管性病変が主たるときは抗血栓療法を、そして糖尿病性認知症では血糖の管理が優先される。実際に、血糖の適正な管理によって、注意・集中力を含む認知機能の一部が改善することは稀ではない。2016年末から我が国でも使用できるようになったflash glucose monitoring systemであるFreeStyle LibrePro(Abbott Diabetes Care)は簡便に装着でき、15分ごとの血糖値を最大14日間まで持続的に測定できる(図3)。DMを合併したADと比較して、糖尿病性認知症では平均血糖値はほぼ同等でも、mean amplitude of glycemic excursions(MAGE)や血糖値の変動係数coefficients variance(標準偏差/平均値:CV)は有意に高く、一方低血糖の出現時間も有意に多く認められた。さらに、MAGEやCV値とMMSEスコアとの間には有意な負の相関もみられた2)。このことは、血糖変動が認知機能障害の重症度と関連し、治療に際しては平均血糖値だけではなく、食後高血糖や血糖の日内変動を抑え、低血糖を予防することが重要であることを示している。
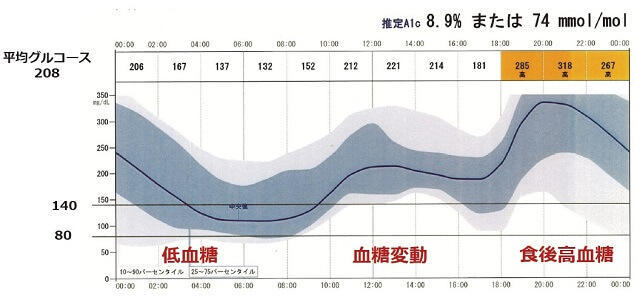
81歳女性で、空腹時血糖は良好にコントロールされていたが、食後高血糖、血糖の日内変動がみられ、また早朝時には低血糖もしばしばみられた。
さらに、インスリン抵抗性はすべての病型に共通してみられ、インスリン抵抗性改善薬は認知症の発症予防や認知機能障害の進行抑制にも期待できる。これまで、ロシグリタゾンやピオグリタゾンを用いたいくつかの研究報告はあるが、それらの結果は必ずしも一致していない。ただし、我々の報告のように糖尿病を合併しインスリン抵抗性が存在する軽症のAD患者では、ある程度の有効性も認められており、対象を限定すれば期待できる可能性がある7)。
また、脳内のインスリン代謝異常を是正する目的から、インスリンの経鼻投与が認知機能の改善につながるという報告もみられ、期待される治療法の1つとなるかもしれない。インクレチン関連薬にも神経突起の成長促進、アポトーシス抑制、Aβの蓄積低下など神経保護的効果が期待され、AD治療薬としての検討もなされている。また、前述したように、炎症、酸化ストレス、AGEが病態や認知機能障害に深く関与していることから、炎症性サイトカインをターゲットとした治療や抗酸化力を高めるような治療も期待できる可能性がある。
6.ケア
高血糖やインスリン抵抗性とフレイルとの関連が注目されているが、我々の検討でも糖尿病のないAD患者よりも糖尿病を有するAD患者で、さらに糖尿病性認知症では有意にプレフレイル、フレイルの頻度が高かった。特に、筋力の低下や歩行速度の低下が有意に多くみられた8)。しかし、バイオインピーダンス法にて筋量を測定するとADやDMを伴うADと比較して有意な筋量の低下は認められなかった。したがって、筋力や筋質の低下、身体機能の低下は、sarcopeniaというよりdynapeniaというべき病態に近いと考えられる9)。高齢のAD患者でも病初期から、筋量の低下を伴わない筋力の低下や歩行速度の低下がみられやすく10)、dynapeniaの方が、ADLや身体機能障害に及ぼす影響は大きいことから、本症ではまさに老年医学的ケアが求められる。
5.おわりに
糖尿病性認知症の臨床像、脳画像所見、脳脊髄液所見、診断のためのガイドライン、病態、治療とケアについて概説した(図4)。糖尿病の適切な治療やコントロールが、認知症の一時的な改善や進行抑制、さらには発症予防も期待できる点で、"controllable dementia"または"preventable dementia"とみなすことができる。糖尿病を伴う認知症の約10%が本症に属し、多くはADと診断されていることが多いが、正確な診断に基づいた適切な治療や管理、ケアが求められる。
(羽生春夫,20182)より引用)
文献
プロフィール

- 羽生 春夫(はにゅう はるお)
- 東京医科大学高齢総合医学分野(高齢診療科) 主任教授
認知症疾患医療センター センター長 - 最終学歴
- 1981年 東京医科大学医学部卒、1985年 東京医科大学大学院老年病学専攻博士課程卒 医学博士
- 主な職歴
- 1982年 東京都老人総合研究所神経病理部門研究員 1990年 東京医科大学老年病科助手 1994年 同・講師 2005年 同・助教授 2007年 同・准教授 2009年 同・教授 2013年 東京医科大学高齢総合医学分野(高齢診療科)主任教授 2015年 東京医科大学病院副院長(2018年8月まで)、同・総合相談・支援センター長(2018年8月まで)、同・認知症疾患医療センター長 現在に至る
- 専門分野
- 老年病学、神経病学(認知症、脳血管障害)など
- 学会
- 日本老年医学会理事、日本老年学会理事、日本認知症学会理事、日本脳血管・認知症学会理事
※筆者の所属・役職は執筆当時のもの
PDFダウンロード
