アルツハイマー病早期診断:画像・体液・感覚器・デジタルバイオマーカー
公開月:2024年5月
栗原 正典(くりはら まさのり)
東京都健康長寿医療センター脳神経内科医員
岩田 淳(いわた あつし)
東京都健康長寿医療センター副院長
アルツハイマー病(AD)の経過とバイオマーカー
アルツハイマー病(AD)は脳内にアミロイドβ(Amyloid beta:Aβ)凝集体である老人斑とtau凝集体である神経原線維変化を認めることを特徴とする。ADは脳内に病理学的変化を認めるが無症状のプレクリニカル期、認知機能低下を認めるが生活機能は保たれた軽度認知障害期を経て認知症へと緩徐に進行する(図)1),2)。早期ADに対してAβモノクローナル抗体レカネマブの有用性が示され3)、わが国でも投与が開始され、早期診断の重要性がますます高まっている。これまで診療では臨床症状と保険診療内で行える画像検査等から"アルツハイマー型認知症"の診断が行われ、コリンエステラーゼ阻害薬などの対症療法が行われてきたが、このようなバイオマーカーを用いない診断では約30%は病理学的にADでなく4)、より早期の軽度認知障害期ではさらに他疾患による認知機能低下と鑑別が困難である5)。
脳内で初期から変化するAβ病理と対応して画像バイオマーカーとしてはアミロイドPETの変化を認め、脳脊髄液バイオマーカーとしてはAβ42・Aβ42/Aβ40の低下、少し遅れてリン酸化タウ(p-tau)の上昇を認めることから1)、これらのバイオマーカーはADの早期診断に有用である。近年は測定系の進歩によりこれらの脳脊髄液変化を簡便に測定できる血液検査で検出できるようになり、今後の医療を大きく変える可能性がある。
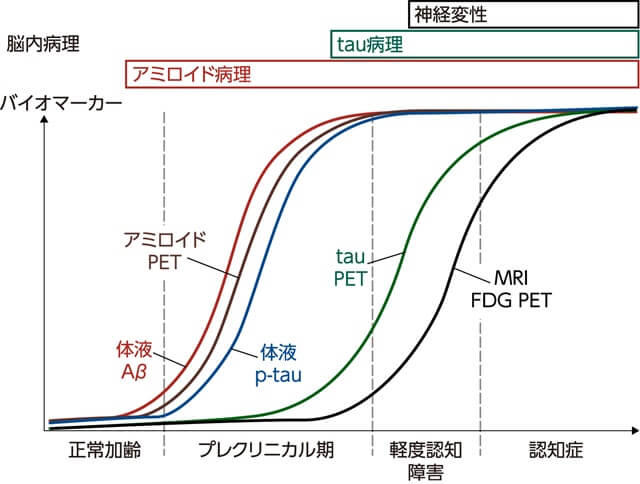
(出典:Jack CR Jr.,Lancet Neurol.20221)と栗原,岩田,臨床精神医学 20232)を参考に筆者作成)
アルツハイマー病ではアミロイドβ(Aβ)・tau・神経変性の順で脳内病理変化が見られる。脳内病理変化は見られるが症状のないプレクリニカル期、軽度の認知機能低下を認めるが生活機能の保たれた軽度認知障害期を経て認知症へと緩徐に進行する。脳内のAβ病理と対応してプレクリニカル期からアミロイドPET・体液(脳脊髄液・血液)のAβ42・Aβ42/Aβ40の低下、少し遅れてリン酸化タウ(p-tau)の上昇などADの早期からバイオマーカーの変化を認める。
画像バイオマーカー
脳内のAβ凝集体を認識するアミロイドPETトレーサーとして2004年に11C-Pittsburgh compound Bが報告され、その後、半減期が長く扱いやすい18F標識のトレーサーとして18F-florbetapir、18F-flutemetamol、18F-florbetabenなどが開発された。これら3剤は本邦でも薬事承認を得ており、2023年12月最適使用推進ガイドライン6)に沿ってレカネマブの投与の要否を判断する場合に限り保険適用となった。その他臨床研究・治験では広く行われており、近年はより早期のプレクリニカル期の抗Aβ抗体療法の治験の参加者を決める根拠ともなっている。
アミロイドPET検査は脳内アミロイド病理に対する特異度の高さや脳内分布情報・定量値も得られるという利点がある。一方で臨床現場においては検査を実施できる施設が限られ、費用も高額であることからもレカネマブなどの抗Aβ抗体の適用を決める場合を除き、広く普及するのは今後も難しいと考えられている。
脳脊髄液バイオマーカー
AD患者の脳脊髄液ではAβ42濃度が低下し7)、リン酸化tau(p-tau)濃度が上昇しており8)、いずれも多数の研究でAD診断における有用性が示された確立した検査である9)。脳脊髄液中のAβ42の減少は脳内への凝集・蓄積による可溶性Aβ42減少を反映していると考えられている。その後の研究でAβ42濃度自体よりもAβ42/40比を用いることで精度が改善されることがわかっている10),11)。Aβ42・Aβ42/40は長らく保険収載されていなかったが、2023年12月最適使用推進ガイドライン6)に沿ってレカネマブの投与の要否を判断する場合に限り、全自動測定系ルミパルス®を用いたAβ42/40比の測定が保険適用となった。181番目のスレオニンにおけるリン酸化を認識する抗体を用いたp-tau181の測定は、本邦では2012年より保険適用となっている。近年は他のリン酸化部位を認識する抗体を用いたp-tau217、p-tau231の上昇がよりADの診断精度が高い可能性も報告されている12)。これらのバイオマーカーは臨床症状が出現する前のプレクリニカル期から脳内病理を反映して変化しており、研究・治験などでは早期診断にも有用である13),14)。
脳脊髄液バイオマーカー検査はこのようにAD診断に有用な確立した検査であり、プレクリニカル期を含めた早期から変化していることが判明しており、PETに比べると安価である。一方で軽度ではあるが侵襲性があり、また脳脊髄液を採取するための腰椎穿刺には医療従事者が一定時間処置に専念する必要があり検査できる患者数には限界があり、早期診断のための大規模なスクリーニングなどは困難である。
血液バイオマーカー
これらの現状からアミロイドPETまたは脳脊髄液バイオマーカーと対応して変化し、簡便で安価に検査できる血液バイオマーカーの研究が盛んに行われてきた。脳脊髄液中に比べて血液中では脳に由来するタンパク量は少なく分解を受けやすい。また他の挟雑タンパクの存在や末梢組織由来の測定対象タンパク質が多量に発現する場合には評価が難しかった15)。しかし免疫沈降と質量分析を組み合わせた測定法や従来のELISA法よりも感度の高いSimoa™などの高感度測定系の技術革新により、血液中のAβ・p-tauを測定することで高い診断精度を確認できた報告が相次いでいる。
2018年国立長寿医療研究センターと島津製作所の共同研究により、免疫沈降法と質量分析を組み合わせて血漿中の関連する他ペプチドAβ42の比をとることで高精度に脳内Aβの有無を判別できることが報告され16)、医療機器承認を得ている17)。また米国C2N Diagnosticからは質量分析計を用いて血漿中のAβ42/40比などを測定しADの可能性を数値化する検査としてPrecivityAD®が商品化され、その他測定系との比較も行われている18)。またより簡便な方法としては、シスメックス株式会社の全自動化学発光酵素免疫測定システムHISCL™-5000/HISCL™-800を用いて少量の検体から短時間で血漿中のAβ42/40比を算出する検査試薬が発売され、アミロイドPETの陽性・陰性を高精度に予測できることが報告されている19),20)。また富士レビオ株式会社からも全自動測定系ルミパルス®G1200を用いた血漿Aβ42、Aβ40測定試薬が欧米で販売されている。
血漿中のp-tau181濃度は脳脊髄液に比べて低く従来は測定が困難であったが、高感度測定系を用いることで測定することができ、診断に有用であることが判明した。その後リン酸化部位の異なるp-tau217およびp-tau231の測定がさらに有用との報告もなされ、各社で測定系の開発が盛んとなり、比較検討なども行われている21),22)。
これらの血液バイオマーカー検査はPETや脳脊髄液検査に比べて簡便に施行でき、すでに治験ではPET検査前の被験者のスクリーニングに用いられており、またPET・脳脊髄液バイオマーカーに匹敵する精度を誇るものもあることから、血液p-tau217上昇単独で被験者を組み入れる治験も開始されている。臨床実装の課題としては脳脊髄液と比べて正常とADで測定値の上昇比が大きくなく、ばらつきが生じやすい臨床現場でも十分な診断精度を確保できるか最終確認が行われている。
感覚器バイオマーカー
ADやレビー小体型認知症では早期から嗅覚障害を認めることが知られる23)。これを用いて認知機能の低下を早期発見することを目指した商品も開発され発売されている。またこれまでよりも簡便に半定量的に嗅覚を評価できる装置も開発され、認知機能低下の早期発見への応用が期待されている。またADでは網膜へのAβ沈着を含めた異常も報告されており24)、網膜画像を用いて非侵襲的にADを早期発見できないか試みられている25),26)。
デジタルバイオマーカー
通常の診療では、もの忘れの自覚があり、問診・簡便な心理検査により年齢・教育背景から想定される認知機能よりも低下を認める場合に軽度認知障害と診断する。しかし、もとの認知機能が高いなど通常の心理検査では客観的な認知機能低下を証明できず、主観的認知機能低下と判断される症例の中にもADが含まれる。また、主観的にも客観的にも認知機能低下のないプレクリニカルADでも詳細な認知機能検査を繰り返し行うと経時的な低下を認める27),28),29)。このことからパソコン・スマートフォンなどを用いて自宅で簡便にできる認知機能検査を定期的に行うことで、ADによるより早期の認知機能低下を検出する試みが盛んに行われている30),31)。またこれらの自宅での認知機能検査と年齢・家族歴などを組み合わせることでより正確にプレクリニカルADを検出できる可能性がある32)。
近年のスマートフォン・ウェアラブルデバイス・人工知能(AI)などのデジタル技術の進歩を受けて、より簡便に取得できる早期ADのデジタルバイオマーカーの研究も盛んに行われている。スマートウォッチ・スマートグラス(眼鏡)などのウェアラブルデバイスで測定した様々なデータを用いて軽度認知障害・認知症患者のスクリーニングが試みられている33)。
おわりに
ADでは確立した脳脊髄液・PETバイオマーカーがあり、これまで診療において広く行われてはこなかったが、レカネマブの登場により今後ますます重要な検査となる。近年血液バイオマーカーの研究・開発も盛んでその有用性に関する知見が集積してきており、侵襲性が低く簡便に採取できることから臨床実装が期待される。また今後はより侵襲が低い感覚器バイオマーカーや、簡便にたくさんのデータを取得できるデジタルバイオマーカーの早期診断への利用にも期待が集まっている。
文献
- Jack CR Jr.: Advances in Alzheimer's disease research over the past two decades. Lancet Neurol. 2022; 21(10): 866-869.
- 栗原正典, 岩田淳: アルツハイマー病におけるバイオマーカーの開発状況. 臨床精神医学 2023: 52 (9); 1047-1053.
- van Dyck CH, Swanson CJ, Aisen P, et al.: Lecanemab in Early Alzheimer's Disease. N Engl J Med. 2023; 388(1): 9-21.
- Beach TG, Monsell SE, Phillips LE, Kukull W.: Accuracy of the clinical diagnosis of Alzheimer disease at National Institute on Aging Alzheimer Disease Centers, 2005-2010. J Neuropathol Exp Neurol. 2012; 71(4): 266-273.
- Rabinovici GD, Gatsonis C, Apgar C, et al.: Association of Amyloid Positron Emission Tomography With Subsequent Change in Clinical Management Among Medicare Beneficiaries With Mild Cognitive Impairment or Dementia. JAMA. 2019; 321(13): 1286-1294.
- Motter R, Vigo-Pelfrey C, Kholodenko D, et al.: Reduction of beta-amyloid peptide42 in the cerebrospinal fluid of patients with Alzheimer's disease. Ann Neurol. 1995; 38(4): 643-648.
- Blennow K, Wallin A, Agren H, et al. Tau protein in cerebrospinal fluid: a biochemical marker for axonal degeneration in Alzheimer disease? Mol Chem Neuropathol. 1995; 26(3):231-245.
- Olsson B, Lautner R, Andreasson U, et al.: CSF and blood biomarkers for the diagnosis of Alzheimer's disease: a systematic review and meta-analysis. Lancet Neurol. 2016; 15(7): 673-684.
- Shoji M, Matsubara E, Kanai M, et al.: Combination assay of CSF tau, A beta 1-40 and A beta 1-42(43) as a biochemical marker of Alzheimer's disease. J Neurol Sci. 1998; 158(2): 134-140.
- Hansson O, Lehmann S, Otto M, et al.: Advantages and disadvantages of the use of the CSF Amyloid β (Aβ) 42/40 ratio in the diagnosis of Alzheimer's Disease. Alzheimers Res Ther.2019 ;11(1): 34.
- Leuzy A, Janelidze S, Mattsson-Carlgren N, et al.: Comparing the Clinical Utility and Diagnostic Performance of CSF P-Tau181, P-Tau217, and P-Tau231 Assays. Neurology. 2021; 97(17): e1681-e1694.
- Bateman RJ, Xiong C, Benzinger TL, et al.: Clinical and biomarker changes in dominantly inherited Alzheimer's disease. N Engl J Med. 2012; 367(9): 795-804.
- Barthélemy NR, Li Y, Joseph-Mathurin N, et al.: A soluble phosphorylated tau signature links tau, amyloid and the evolution of stages of dominantly inherited Alzheimer's disease. Nat Med. 2020; 26(3): 398-407.
- Ashton NJ, Hye A, Rajkumar AP, et al.: An update on blood-based biomarkers for non-Alzheimer neurodegenerative disorders. Nat Rev Neurol. 2020;16(5):265-284.
- Nakamura A, Kaneko N, Villemagne VL, et al.: High performance plasma amyloid- β biomarkers for Alzheimer's disease. Nature. 2018; 554(7691): 249-254.
- 「認知症に関する脳脊髄液・血液バイオマーカー、APOE検査の適正使用指針」作成委員会. 認知症に関する脳脊髄液・血液バイオマーカー、APOE検査の適正使用指針.
- Janelidze S, Teunissen CE, Zetterberg H, et al.: Head-to-Head Comparison of 8 Plasma Amyloid-β 42/40 Assays in Alzheimer Disease. JAMA Neurol. 2021; 78(11): 1375-1382.
- Yamashita K, Miura M, Watanabe S, et al.: Fully automated and highly specific plasma β -amyloid immunoassays predict β -amyloid status defined by amyloid positron emission tomography with high accuracy. Alzheimers Res Ther. 2022; 14(1): 86.
- Bun S, Ito D, Tezuka T, et al.: Performance of plasma A β 42/40, measured using a fully automated immunoassay, across a broad patient population in identifying amyloid status. Alzheimers Res Ther. 2023; 15(1): 149.
- Janelidze S, Bali D, Ashton NJ, et al.: Head-to-head comparison of 10 plasma phospho-tau assays in prodromal Alzheimer's disease. Brain. 2022: awac333.
- Doty RL.: Olfactory dysfunction in neurodegenerative diseases: is there a common pathological substrate? Lancet Neurol. 2017; 16(6): 478-488.
- Hart NJ, Koronyo Y, Black KL, Koronyo-Hamaoui M.: Ocular indicators of Alzheimer's: exploring disease in the retina. Acta Neuropathol. 2016; 132(6): 767-787.
- Hadoux X, Hui F, Lim JKH, et al.: Non-invasive in vivo hyperspectral imaging of the retina for potential biomarker use in Alzheimer's disease. Nat Commun. 2019; 10(1): 4227.
- Cheung CY, Ran AR, Wang S, et al.: A deep learning model for detection of Alzheimer's disease based on retinal photographs: a retrospective, multicentre case-control study. Lancet Digit Health. 2022; 4(11): e806-e815.
- Sperling RA, Aisen PS, Beckett LA, et al.: Toward defining the preclinical stages of Alzheimer's disease: recommendations from the National Institute on Aging-Alzheimer's Association workgroups on diagnostic guidelines for Alzheimer's disease. Alzheimers Dement. 2011; 7(3): 280-292.
- Donohue MC, Sperling RA, Salmon DP, et al.: The preclinical Alzheimer cognitive composite: measuring amyloid-related decline. JAMA Neurol. 2014; 71(8): 961-970.
- Donohue MC, Sperling RA, Petersen R, Sun CK, Weiner MW, Aisen PS; Alzheimer's Disease Neuroimaging Initiative.: Association Between Elevated Brain Amyloid and Subsequent Cognitive Decline Among Cognitively Normal Persons. JAMA. 2017; 317(22): 2305-2316.
- Öhman F, Hassenstab J, Berron D, Schöll M, Papp KV.: Current advances in digital cognitive assessment for preclinical Alzheimer's disease. Alzheimers Dement (Amst). 2021; 13(1): e12217.
- Papp KV, Jutten RJ, Soberanes D, et al.: Early Detection of Amyloid-Related Changes in Memory among Cognitively Unimpaired Older Adults with Daily Digital Testing. Ann Neurol. 2023 Nov 22. doi: 10.1002/ana.26833. Epub ahead of print.
- Sato K, Ihara R, Suzuki K, et al.: Predicting amyloid risk by machine learning algorithms based on the A4 screen data: Application to the Japanese Trial-Ready Cohort study. Alzheimers Dement (N Y). 2021; 7(1): e12135.
- Kourtis LC, Regele OB, Wright JM, Jones GB.: Digital biomarkers for Alzheimer's disease: the mobile/ wearable devices opportunity. NPJ Digit Med. 2019; 2: 9.
筆者

- 栗原 正典(くりはら まさのり)
- 東京都健康長寿医療センター脳神経内科医員
- 略歴
- 2012年:東京大学医学部医学科卒業、国立国際医療研究センター病院初期研修、2014年:東京大学神経内科入局、2019年:日本学術振興会特別研究員(DC2)、2021年7月:東京大学大学院医学系研究科医学博士、2021年8月より東京都健康長寿医療センター脳神経内科医員、認知症未来社会創造センター研究員
- 専門分野
- 認知症性疾患、神経内科学、バイオマーカー
- 岩田 淳(いわた あつし)
- 東京都健康長寿医療センター副院長
- 略歴
- 1993年:東京大学医学部医学科卒業、2002年:東京大学大学院修了、2010年:科学技術振興機構「さきがけ」研究員、2019年:東京大学大学院医学系研究科神経内科学准教授、2020年より東京都健康長寿医療センター脳神経内科部長、2023年より東京都健康長寿医療センター副院長
- 専門分野
- 臨床神経内科学
WEB版機関誌「Aging&Health」アンケート
WEB版機関誌「Aging&Health」のよりよい誌面作りのため、ご意見・ご感想・ご要望をお聞かせください。
お手数ではございますが、是非ともご協力いただきますようお願いいたします。
