総論 フレイルの全体像を学ぶ 7.栄養によるフレイル予防 ②最新の栄養サポート戦略
公開月:2021年9月
熊本リハビリテーション病院 リハビリテーション科 副部長
吉村 芳弘
1:栄養とフレイル
フレイル対策に栄養の果たす役割は大きい。フレイルは身体的、社会的、精神心理的側面を持つことを特徴とするが、いずれの側面も高齢者の食生活や栄養状態へ影響を与えうる。
低栄養とフレイルの関係は密接な関連がある(表1)1)。先行研究の多くはMini Nutritional Assessment®(MNA®)を使用して栄養評価をしている。一方で、体格指数(body mass index:BMI)とフレイル有症率の関係はU-shapeの関係にあり、最も有症率が低いのはBMI25.0-20.9kg/m2の範囲であった2)。また、BMIが高値でも低値でも腹囲長が高値であるほどフレイルとの関係が強い。ただし、この報告は英国からのものであり、このBMI値を本邦の高齢者にそのまま当てはめることは不適切である。肥満(BMI≧30kg/m2)とフレイルの関係は、他の海外の報告にも認められる3)。したがって、栄養とフレイルの関係は低栄養と肥満のいずれもが関与していることが示唆される。
表1 フレイルと栄養(素)・食事との関係はあるのか?
(フレイル診療ガイド2018年度版)(荒井秀典,20181)より著者作成)
要約
- 栄養状態はフレイルと関連がある(エビデンスレベル:E-2)
- 微量栄養素、特に血清ビタミンD低値はフレイルのリスクとなる(エビデンスレベル:E-1b)
- 地中海食を始めバランスの取れた良質な食事はフレイルを予防する可能性がある(エビデンスレベル:E-1b)
- 疫学研究のエビデンスレベル
- E-1a コホート研究のメタアナリシス
- E-1b コホート研究
- E-2 症例対照研究、横断研究
- E-3 記述研究(ケースシリーズ)
高齢者におけるBMIと総死亡率との関連を図1に示す。高齢者では低体重でも肥満でも死亡率が上昇するが、特に低体重と死亡との関係が強い4、5)。しかし、体組成をみると、加齢に伴い筋肉が脂肪に置き換えられ体内総水分量が減少する(表2)6)。したがって、高齢になるほど体重やBMIだけで栄養評価することは危険である。
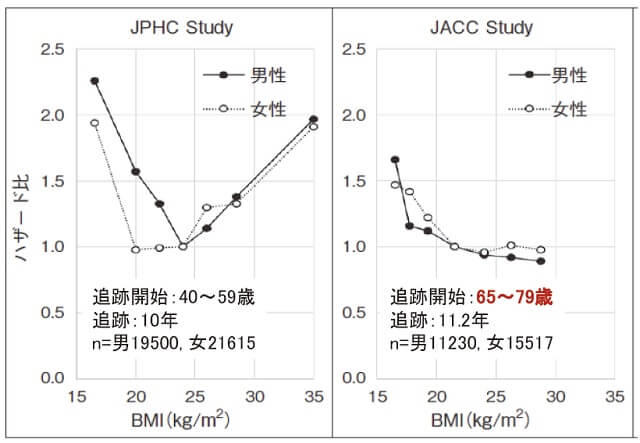
(Tsugane S, et al, 20024)& Tamakoshi A, et al, 20105)より著者作成)
| 成人 (AV.38歳) | 高齢者 (AV.68歳) | 後期高齢者 (AV.81歳) | 加齢による変化 | |
|---|---|---|---|---|
| 体重(kg) | 70 | 69 | 62 | ↓ |
| BMI(kg/m2) | 23 | 26 | 25 | ↑ |
| 総水分量(kg) | 41 | 34 | 30 | ↓ |
| 除脂肪量(kg) | 56 | 46 | 42 | ↓ |
| 体脂肪率(%) | 20 | 33 | 32 | ↑ |
2:低栄養と高齢者
一昔前の臨床栄養関連のテキストを紐解くと、典型的な低栄養の病態としてマラスムスとクワシオコルが掲載されている。マラスムスとは慢性のエネルギー蛋白欠乏状態(Protein Energy Malnutrition:PEM)であり、クワシオコルとは急性の蛋白欠乏状態である。テキストに添付される患者の写真を見ると、いずれも痩せこけた発展途上国の小児である。
高齢者の低栄養の病態はマラスムスやクワシオコルだけで説明できるだろうか?答えは正であり、否である。原因は疾患の存在である。疾患を合併しない高齢者の低栄養の原因は主に栄養素の欠乏であり、病態はマラスムスやクワシオコル、もしくは2つの混合型に近い。しかし、疾患を合併した高齢者の低栄養の原因や病態は、栄養素の欠乏だけでは説明ができない。疾患に伴う炎症の存在が背景にある。
急性疾患等に伴う短期間の急激な炎症惹起を侵襲、慢性疾患に伴う長期間の微弱な炎症惹起を悪液質とよぶ。いずれも高齢者の低栄養の主因である。2012年にAND(米国栄養と食のアカデミー)とASPEN(米国静脈経腸栄養学会)が高齢者の低栄養に関するコンセンサス声明を共同で提出した(図2)7)。高齢者を含む成人の栄養障害の原因として、急性疾患(≒侵襲)、慢性疾患(≒悪液質)、社会生活環境(≒飢餓)の3つが提言されている。栄養障害は飢餓(栄養摂取不足)と炎症の複合によって生じ、かつ炎症の程度によって分類されることが明示されている。マラスムスとクワシオコルは広義の飢餓に相当する。高齢者の低栄養の診断や分類には疾患や炎症の合併を常に考慮する必要性がある。
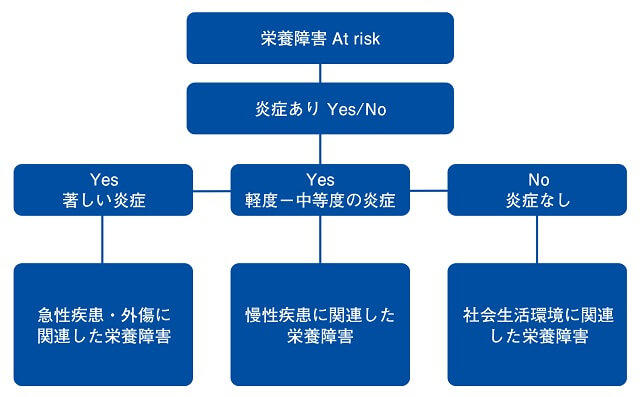
(White JV, et al, 20177)より著者作成)
短期飢餓、長期飢餓、侵襲でのエネルギー代謝の相違を図3に示す8)。飢餓および侵襲における糖質、脂質、蛋白質のエネルギー代謝や主要臓器の相違は多岐にわたり、「栄養障害=栄養不足」という前世紀の単純な栄養診断がいかに危険であるかは一目瞭然である。すなわち、入院高齢者の栄養評価においては、BMI、体重減少、摂食量、体組成、浮腫、握力に加えて、主病名の治療経過や、併存疾患の管理状態についても確認すべきである。
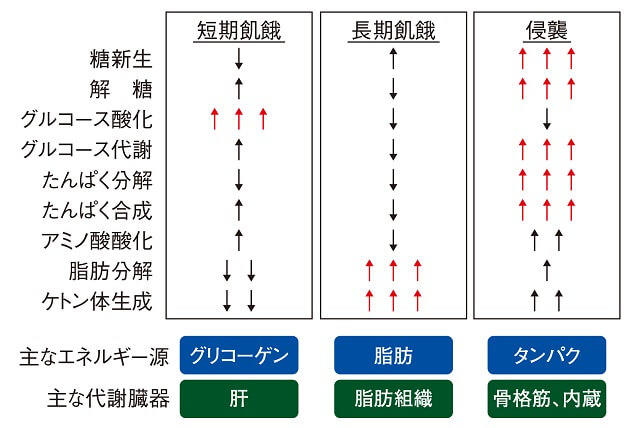
(Long CL, et al, 19798)より著者作成)
3:低栄養が高齢者に与えるインパクト
低栄養をきたしうる病態を表39)に示す。いずれも低栄養の原因と結果になりうるため、それぞれの病態の理解に努める必要がある。高齢の低栄養患者は重篤な低栄養になるまで、患者自身が社会的、審美的に障害があるとは感じないかもしれない。しかし、例えばごく軽度の皮下浮腫であっても、背後に細胞数減少や機能障害などの重篤な生理学的障害を来している危険性がある。低栄養の臨床的合併症として様々なものが報告されているが、代表的なものに感染症や創傷治癒遅延、転倒/骨折、長期入院、生活の質の低下などがある(表4)9)。
| 診断 | 特徴 |
|---|---|
| 消耗性疾患Wasting | Body cell massの減少。浮腫や低Alb血症は伴わないことが多い。 |
| サルコペニアSarcopenia | 骨格筋量の減少。筋力や機能低下を伴う。 |
| サルコペニア肥満Sarcopenic obesity | サルコペニア+肥満 |
| 悪液質Cachexia | 炎症性疾患を伴う低栄養。浮腫や低Alb血症を伴いやすい。 |
| PEM Protein‐energy malnutrition | 食事量減少に伴うbody cell massの減少。浮腫や低Alb血症を伴いやすい。 |
表4 低栄養の臨床的合併症
(吉村芳弘, 20199)より著者作成)
- 免疫能の低下、感染症
- 褥瘡、創治癒遅延
- 歩行不安定、転倒、骨折
- 認知機能低下、依存
- 治療抵抗性
- 長期入院、頻回の再入院
- QOLの低下
- 予後不良の合併症
低栄養の影響は病院だけにとどまらない。地域高齢者における3年後の死亡率は低栄養の有無でその差が4倍にまで拡大する(図4)10)。低栄養の高齢者は再入院を繰り返し(図4)11)、褥瘡を容易に形成し12)、死に直結する重大な合併症を併発し、医療制度に多大な負荷をあたえる。
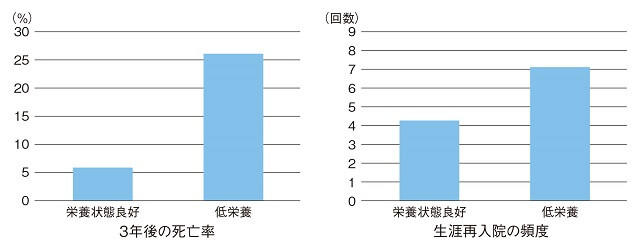
(Lim SL, et al, 201210)& Lobo Tamer G, et al, 200911)より著者作成)
低栄養は医学的に有害であるだけでなく、医療経済的にコストが上昇する。低栄養では入院期間が延長するだけでなく、合併症のマネジメントのためにより多くの薬物や物的/人的コスト、診断ワークアップ、治療介入を浪費する。低栄養高齢者の健康寿命は、併存疾患および後遺症の増加とともに、早期および晩期死亡率の上昇によって短縮する。退院後の医療サービスの集中的な利用も必要であり、低栄養は疾患とは独立した大きなコスト要因となっている。患者および保険会社、医療機関、国家医療システムのそれぞれの低栄養患者の財政負担を表5に示す9)。
| 推定 | 患者、医療機関、国家レベル |
|---|---|
| 200-1700 ユーロ(EU) | 患者(追加費用) |
| 1064-1630 米ドル | 患者(追加費用) |
| 86,000 米ドル | 医療機関 |
| 35,280 ユーロ(EU) | 医療機関 |
| 1,670,000-1,850,000 豪ドル | 医療機関 |
| 10,200,000,000 ユーロ(フランス) | 国家 |
| 9,000,000,000 ユーロ(ドイツ) | 国家 |
| 7,300,000,000 英ポンド | 国家 |
4:低栄養の評価
1.スクリーニング
栄養評価のプロセスは1.スクリーニング、2.低栄養診断、3.栄養アセスメントの3段階に分けられる。スクリーニングは基本的に全ての症例を対象として行い、低栄養のリスク者を抽出する。そのため、簡便で、短時間に実施でき、実施者を選ばない信頼性と妥当性が検証済みのスクリーニングツールが用いられる。表6に代表的なスクリーニングツールを示す13-16)。
| 名称 | 特徴 |
|---|---|
| MNA‐SF: Mini Nutritional Assessment - Short Form [13] | 65歳以上の高齢者向け問診ツール: 体重減少、食事摂取量、歩行能力、急性疾患の影響、認知症やうつの有無、やせ(BMIや下腿周囲長)をスコア化 |
| MUST: Malnutrition Universal Screening Tool [14] | 成人全般の問診ツール: 体重減少率、やせ(BMI)、疾患の影響をスコア化 |
| NRS2002: Nutritional Risk Screening 2002 [15] | 急性期病院向けの問診ツール: 体重減少率、やせ(BMI)、疾患の影響をスコア化 |
| MST: Malnutrition Screening Tool [16] | 医療現場で用いられる簡易な問診ツール: 体重減少の有無と程度、食事摂取量をスコア化 |
臨床栄養に関連する国際的な4つのワーキンググループにより、全世界的な低栄養診断基準が2018年に発表された。GLIM(Global Leadership Initiative on Malnutrition)である17)。GLIM基準は世界規模では初めての低栄養診断基準であり、本邦を含めた今後のスタンダードな診断基準になることが期待される。GLIM基準による低栄養診断のアルゴリズムでは、リスクスクリーニング(汎用されている簡易なツールを用いる)→アセスメント(現症と病因に基づく)→診断(現症と病因よりそれぞれ一つ以上該当)→重症度判定(現症に基づく)の流れが提言されている(図5)。
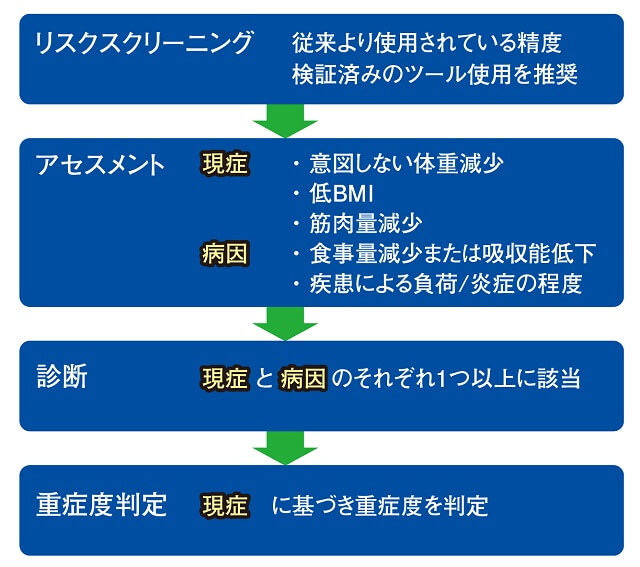
2.低栄養診断(GLIM基準)
GLIM基準では、現症の3要素(体重減少、BMI、骨格筋量)のうち1つ以上の要素で異常を認め、かつ病因の2要素(食事摂取量の減少または疾患による消化吸収問題、炎症や外傷性疾患の影響)のうち1つ以上の要素に異常を認める場合に低栄養と診断する(図6)17)。
重症度は低栄養診断の現症の3要素を用いて、中等度もしくは重度の低栄養かを判定する(図6)17)。1つでも重度低栄養の基準を満たすと重度の低栄養と診断する。GLIM基準はグローバルな基準として発表されており、人種毎に異なるカットオフ値が示されている。例えばアジア人のBMIのカットオフ値は70歳未満では18.5kg/m²未満、70歳以上では20.0kg/m²未満を用いることが推奨されている。
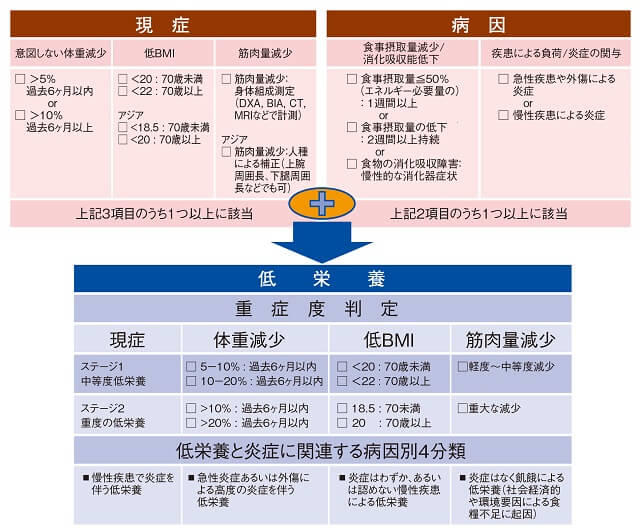
(Cederholm T, et al, 201917)より著者作成)
また、GLIM基準では低栄養の診断として初めて骨格筋減少を基準として採用している。フレイルやサルコペニア患者を抽出するにあたって、骨格筋量減少の有無は重要な評価項目である。低栄養はフレイルやサルコペニアを誘発する重要な因子であり、低栄養患者の判定の際にGLIM基準を用いることでフレイル患者の早期発見・介入に繋がる可能性がある一方で、GLIM基準におけるBMI、体重減少や骨格筋評価は、うっ血や浮腫の影響が強い場合には注意を要し、浮腫を認めない、あるいは浮腫が軽度である安定期の体重・筋量を用いることが重要である。また、サルコペニアの診断に用いる下腿周囲長で浮腫を認める場合は補正を要する。
3.アセスメント
栄養アセスメントでは栄養状態に関連する項目を多面的かつ詳細に記述する。低栄養のリスクがある場合や低栄養と診断された場合に、トレーニングされた栄養の専門家が行うべき評価である。栄養アセスメントには大まかには身体計測(体重、BMI、腹囲、下腿周囲長など)、生化学検査(血液検査や尿検査など)、臨床初見(身体診察や精神・心理的診察)、身体機能検査(握力、歩行速度など)、食事調査などが含まれる。
ただし、低栄養診断に基本的には血液検査は不要である。食欲低下や摂取量の低下、体重減少、引き続き生じる合併症を把握することはフレイルの予防・治療に直結し、基本的な低栄養の診断になる(図7)18)
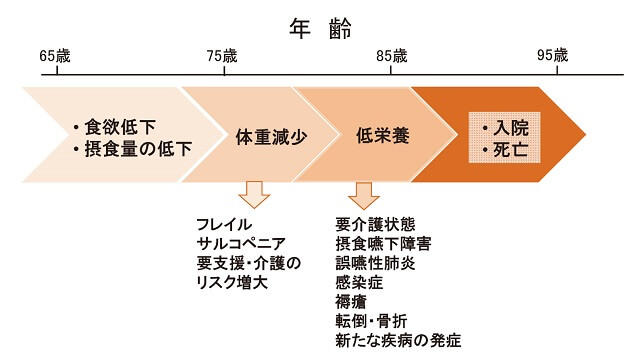
(葛谷雅文, 201818)より著者作成)
5:栄養介入・栄養治療
フレイルに対する栄養介入は効果がある。フレイル診療ガイド2018年度版(表7)1)およびアジア太平洋のフレイル管理の診療ガイドライン(表8)19)、International Conference for Frailty and Sarcopenia Research(ICFSR)のフレイル高齢者の特定と管理のためのエビデンスに基づく推奨(表9)20)のいずれにおいても栄養評価、栄養教育、栄養治療の推奨が明記されており、フレイル対策に栄養管理は不可欠である。
表7 フレイルに対する栄養介入の効果はあるのか?
(フレイル診療ガイド2018年度版)(荒井秀典,20181)より著者作成)
要約
- 栄養教育、栄養補助食による単独介入の効果は弱く推奨する(エビデンスレベル:1、推奨レベル:弱い)
- 運動療法と栄養補助製品との併用療法は推奨する(エビデンスレベル:1+、推奨レベル:強い)
- 治療・診断のエビデンスレベル
- 1+:質の高いRCTおよびそれらのMA/SR
- 1:それ以外のRCTおよびそれらのMA/SR
- 2:前向きコホート研究およびそれらのMA/SR
- 3:非ランダム化比較試験、前後比較試験、後ろ向きコホート研究、ケースコントロール研究およびそれらのMA/SR、RCT後付けサブ解析
- 4:横断研究、症例集積
| 栄養に関連する推奨 | 詳細 |
|---|---|
| 強い推奨 |
不適切または不要な薬物を減少または中止することでポリファーマシーに対処する |
| 条件付きの推奨 |
|
| 栄養と口腔衛生に関する推奨 | 推奨度 | エビデンスの確実性 |
|---|---|---|
| 体重減少または低栄養と診断されたフレイル患者では、たんぱく質およびエネルギー補助食品の提供を考慮してもよい | 条件付き | とても低い |
| 医療従事者は、栄養/たんぱく質補助食品を身体活動と同時に提供してもよい | 条件付き | 低い |
| 口腔衛生の重要性について、フレイル高齢者にアドバイスする | コンセンサスに基づいた推奨事項 | データなし |
特に重要な栄養素がたんぱく質である。日本人の食事摂取基準(2020年度版)によると、サルコペニア・フレイルを予防するためにはそれほど身体活動レベルが高くなくても高齢者ではたんぱく質は1.2-1.5g/kg体重/日は必要である(表10)21)。高齢者は毎食良質なたんぱく質を25-30g程度摂取しなければ骨格筋で有効なたんぱく合成が一日を通して維持できない可能性がある。
表10 日本人の食事摂取基準(2020年版)の要点
(厚生労働省,201921)より著者作成)
- 日本人の食事摂取基準(2020年度版)ではフレイル・サルコペニアの予防のためにたんぱく質目標量が設定された。
- 高齢者(75歳以上)のたんぱく質目標量は身体活動レベルにより異なり、身体活動レベルが「低」では男性で1.25~1.50g/kg体重/日、女性では1.09~1.4g/kg/日、活動度レベルが「中」では男性で1.3~1.76g/kg体重/日、女性では1.27~1.79g/kg体重/日とされている。
- 平成22年、23年国民健康・栄養調査の結果では、たんぱく質摂取量の平均値は男性70歳以上では、71.9g/日(標準偏差:23.4g/日)となっている。女性では、70歳以上で61.5g/日(標準偏差:19.9g/日)となっている。平均値でみると比較的十分なたんぱく質量を摂取しているように見えるが、標準偏差が大きく、推奨量に満たない対象者が相当数いることが想像できる。
日本人の食事摂取基準2020年度版
しかしながら、栄養単独の介入では効果が乏しいという報告もある。サルコペニア診療ガイドライン2017年度版(一部改定2020年)によれば、サルコペニア患者に対して運動介入と栄養介入は、それぞれの単独介入に比べサルコペニアの改善に有効であり推奨される、としている(表11)22)。地域在住の高齢女性を対象としたランダム化介入研究では、運動とアミノ酸摂取群の骨格筋量の改善効果が最も高かった(図8)23)。
| CQ | ステートメント |
|---|---|
| 複数の治療法の組み合わせはサルコペニアの治療法として有効か? | サルコペニアを有する人へのレジスタンストレーニングを含む包括的運動介入と栄養療法による複合介入は、単独介入に比べサルコペニアの改善に有効であり、推奨される。しかしながら、長期的アウトカム改善効果は明らかではない。 (エビデンスレベル:低、推奨レベル:強) |
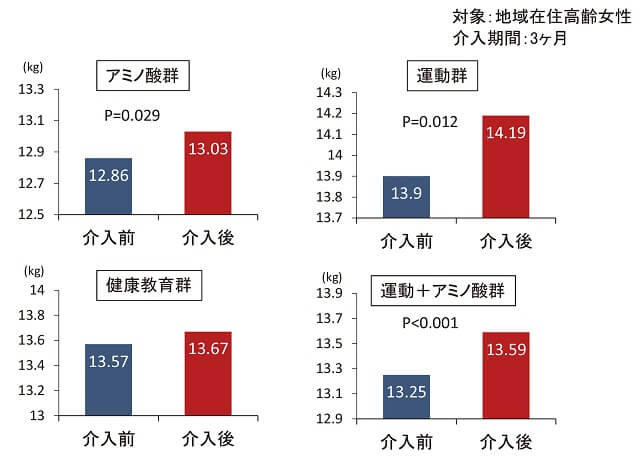
(Kim HK, et al, 201223)より著者作成)
6:栄養治療の費用対効果
低栄養に対する栄養治療は医療コストを削減する。低栄養の高齢患者は入院中に30-70%の追加費用が生じる24)。本邦を含めた多くの国で、栄養サポートに関連した医療行為はすでに診療報酬として公的あるいは私的保険の対象となっている。これらの医療行為には、栄養アセスメント、栄養ケアプラン、経口補助食品、経腸栄養、静脈栄養、などが含まれる。いずれもルーチンとしての栄養スクリーニングから開始される。栄養スクリーニングがルーチン化されなければ、患者は低栄養の診断をされることなく、医療機関にはさらなる財政的な負担を生じることになる。
栄養療法の効果は2倍から5倍、またはそれ以上の費用対効果がある。オランダの調査では、栄養スクリーニングと栄養サポートに投資した76ユーロで、入院期間を1日短縮することができた25)。対して、同時期のオランダの入院費用は、脳卒中で1日当たり433ユーロ、心筋梗塞で1日当たり909ユーロに及んだ25)。
栄養補助食品(Oral nutritional supplement:ONS)の臨床効果も複数のメタアナリシスで報告されている(表12)9)。食欲不振や吸収不良、臓器不全、エネルギー需要の増加、特定の栄養素の欠乏などに対応する様々なONSが設計されている。特に高齢者や疾患に罹患した入院患者に対する栄養治療としてONSは有用である。
| 対象 | 臨床効果 |
|---|---|
| 高齢者 | 合併症の減少(32%)、再入院の減少(41%) |
| COPD | 経口摂取の改善、身体測定値や握力の改善 |
| がん | 経口摂取の改善、QOLの改善 |
| 高齢者 | 良好なコンプライアンス(78%)、経口摂取の改善、臨床指標の改善 |
| 高齢者 | 体重増加、認知機能改善 |
| 高齢者 | エネルギー摂取増加、体重増加 |
| COPD | QOLの改善、運動能力やリハビリテーションによる改善効果 |
| 肝不全 | 肝性脳症の減少 |
| COPD | エネルギー・蛋白質摂取の増加、入院期間の短縮 |
7:まとめ
フレイル対策に栄養の果たす役割は大きい。低栄養はフレイルを惹起、促進する重要な要素の1つである。フレイルと低栄養の関連、低栄養の治療の効果に対するエビデンスが集積しつつある。適切な低栄養スクリーニング、低栄養診断、栄養治療を行うことで、フレイル高齢者の健康寿命の延伸が期待される。
文献
プロフィール

- 吉村 芳弘(よしむら よしひろ)
- 熊本リハビリテーション病院 リハビリテーション科 副部長
- 最終学歴
- 2001年 熊本大学医学部卒
- 主な職歴
- 2013年 熊本リハビリテーション病院 2020年 同病院・サルコペニア・低栄養研究センター長 現在に至る
- 所属学会
- 日本サルコペニア・フレイル学会(理事, 学会誌編集委員長, 2017年度版サルコペニア診療ガイドライン作成委員)、日本リハビリテーション医学会(指導医、専門医, 認定臨床医)、日本臨床栄養代謝学会(代議員, 学術評議員、国際委員, 指導医など)、日本リハビリテーション栄養学会(理事、2023年度版リハ栄養診療ガイドライン統括委員長など)。
