各論1 様々な臨床病態とフレイルの関連 2.認知機能低下とフレイル:認知的フレイルの概念と介入方法
公開月:2021年9月
国立長寿医療研究センター
老年学・社会科学研究センター長
島田 裕之
1:フレイルと認知機能低下との関係
フレイルの構成要素の中でも身体的フレイルについては多くの先行研究によって操作的定義がなされ、それらとアウトカムとの関連、身体的フレイル予防や改善方法などが整理されてきた。そのアウトカムのひとつが認知症であり、幾つかの疫学研究によってフレイルと認知症との関連が明らかにされている。
Rush Memory and Aging Projectに参加した認知症のない823名の高齢者を対象とした縦断研究では、3年間の追跡調査中に89名がアルツハイマー病を発症した。ベースライン時にフレイルの高齢者がアルツハイマー病を発症するハザード比は2.10(95%信頼区間1.27-3.46)であり、フレイルがアルツハイマー病発症の危険因子であることが明らかとされた。この研究におけるフレイルの判定は、握力、歩行速度、体格指数(Body Mass Index)、疲労感が用いられている1)。
一方、Adult Changes in Thought (ACT)studyに参加した65歳以上の認知症のない高齢者2,619名を対象とした縦断研究では、平均追跡期間6.5年のうちに521名が認知症(448名はアルツハイマー病)を発症した。フレイルの把握は体重減少、疲労、身体活動の低下、歩行速度の低下、筋力低下の要素を含むこととし、3個以上該当した場合をフレイルとしている。共変量を調整したモデルにおいて、フレイルとすべての原因による認知症(ハザード比1.20、95%信頼区間0.85-1.69)、およびアルツハイマー病発症(ハザード比1.08、95%信頼区間0.74-1.57)との関連は認められず、アルツハイマー病以外の認知症との関連が認められた(ハザード比2.57、95%信頼区間1.08-6.11)2)。なお、ベースライン時の認知機能で対象者を層化した分析では、高い認知機能を有していた群では、すべての原因による認知症とフレイルとの関連が認められ(ハザード比1.78、95%信頼区間1.14-2.78)、低い認知機能の群では関連が認められなかった(ハザード比0.79、95%信頼区間0.50-1.26)。
これらの結果から、フレイルと認知症とが関連することは明らかであるものの、それぞれの発症原因については同じ病因からの成立と、異なる病因による影響が重畳した結果であることを示唆している。たとえば、フレイルと認知障害との関係を調べたシステマティックレビューでは、フレイル高齢者におけるアルツハイマー病理の存在、テストステロン、栄養状態、慢性炎症、脳血管疾患のリスク、うつ病などの精神衛生が共通した要因としてあげられている3)が、これらの要因がフレイルと認知症のどちらに優位に影響するか、あるいは要因間の交互作用等についての知見は十分ではなく、今後の研究が必要である。
2:認知的フレイル
身体的フレイルに対して認知的フレイルについての知見は十分ではなく、その定義やスクリーニング方法について一定の見解が得られていない状況にある。2013年にInternational Academy on Nutrition and AgingとInternational Association of Gerontology and Geriatricsは、認知的フレイルの定義に関する論文を発表した4)。そこでは、認知的フレイルを身体的フレイルと認知障害を合併した状態と整理している。また、認知的フレイルと同様に運動機能低下と認知的側面の問題の合併を、ひとつの症候としてとらえた概念にmotoric cognitive risk syndrome5)がある。これは歩行速度の低下と主観的な認知機能の低下によって評価され、より簡便なスクリーニングツールとして利用ができ認知機能低下のリスクの把握5)や認知症のリスク把握6)、要介護認定の発生予測7)のために有益であることが明らかにされている。
認知的フレイルの概念定義に基づいて、身体的フレイルを日本版フレイル基準8)で調査し、認知障害をNational Center for Geriatrics and Gerontology-Functional Assessment Tool (NCGG-FAT)9)の認知機能検査にて、年齢と教育歴で標準化した平均値から1.5標準偏差より低下した項目が複数あった場合を認知障害ありと定義して有病率を求めた。その結果、8,864名の対象者の内、認知的フレイルに該当した高齢者はわずか109名(1.2%)であった10)。また、認知的フレイルと手段的日常生活動作との関連をみると、身体的フレイルや認知障害のみを持つ高齢者より認知的フレイルを持つ高齢者において、高いリスクが観察され、日常生活機能の保持のために介入すべきリスクの高い集団であることが示された。また、4,072名の高齢者を対象として、24か月間の認知症発症を追跡調査した結果、認知障害を有した高齢者(ハザード比3.85、95%信頼区間2.09-7.10)と認知的フレイルを有する高齢者(ハザード比6.19、95%信頼区間2.70-13.99)において認知症発症と有意な関連が認められた。身体的フレイルを認知症発症との関連は認められなかった。この結果から、認知障害を有する高齢者は認知症リスクが高く、さらに身体的フレイルを合併した場合には認知症発症リスクの増大が示された。ただし、該当者が1%程度しか存在しないということは、このカテゴリーに該当しなくてもリスクを持つ高齢者が相当数存在すると考えられ、地域でのスクリーニングとしてこの定義のみを利用することは注意深く検討する必要があると考えられた。
そこで地域での一次スクリーニングとして、将来の疾病や障害のリスクのある高齢者を見逃す可能性を減少させるため、基準を緩和して認知的フレイルを操作的に定義した(表1)11)。4,570名の高齢者を対象にフレイルの検査後に36か月間の認知症発症の追跡調査を実施した結果、初期調査時に身体的フレイルのみを有する高齢者が17.4%、認知障害のみの者が15.4%、これらを合併した認知的フレイルの者が9.6%となり、以前の基準より多くの高齢者が認知的フレイルに該当した。また、追跡期間中の認知症発症率は認知的フレイルにおいて高く(図1)、混乱要因を投入したCox比例ハザードモデルにおいても認知障害(ハザード比2.06、95%信頼区間1.41-3.02)と認知的フレイル(ハザード比3.43、95%信頼区間2.37-4.97)は、フレイルのない高齢者と比較して高いハザード比を示した(図2)11)。
| フレイルの種類 | 定義 |
|---|---|
| 身体的フレイル | 下記の基準にて1項目以上該当した場合 握力:男性26kg未満、女性18kg未満 歩行速度:1.0m/s未満 |
| 認知障害 | NCGG-FATの記憶、注意、実行機能、処理速度の4要素のうち1項目以上が5歳年齢階級の平均から1.5標準偏差以上低下が認められた場合 |
| 認知的フレイル | 身体的フレイルと認知障害を合併した場合 |
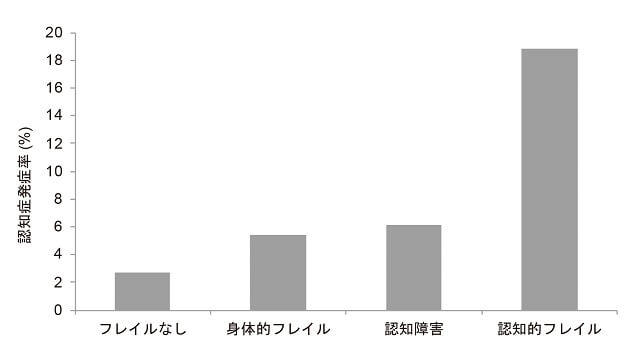
(Shimada, 201811) より引用)
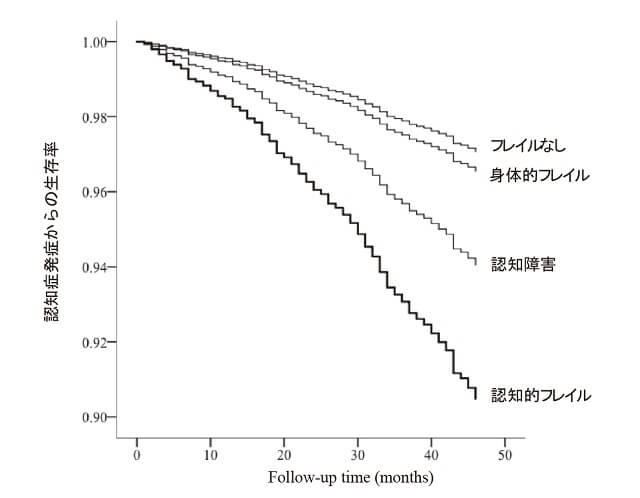
a:フレイルなし、b:身体的フレイル、c:認知障害、d:認知的フレイル
(Shimada, 201811)より著者作図)
以上の結果から、身体的パフォーマンスの低下と認知障害の合併は、地域在住高齢者の10%程度に存在し、その症状は近い将来の認知症発症の危険因子であり、単独の症状よりも高い危険を持つといえる。高齢者のヘルスケアに携わる医療スタッフは、身体や神経心理学的検査から認知的フレイルのスクリーニングを行い、その症状を持つ高齢者に対しては、集中的なアプローチを検討する必要があるだろう。
3:身体的フレイルに対する介入方法
認知的フレイルの概念整理、操作的定義に関する国際的なコンセンサスが十分ではなかったため、認知的フレイルそのものをターゲットとした介入研究は見当たらないが、身体的フレイルや認知機能低下に対する介入研究は多く、有効な介入方法が明らかにされている。身体的フレイルに関しては、身体活動や運動による効果検証が多く行われている。高齢期においても適切なトレーニングによって筋肥大や筋力向上が可能であることが明らかとなり、効果的なトレーニング方法が示されてきた。たとえば、重りや油圧などを利用しておこなうレジスタンストレーニングは、短期間のうちに高い効果を得ることが可能であり、自身の体重を利用して行う運動でも、筋力を向上させることが可能である。筋力の向上は、筋肥大によってもたらされる場合と神経系メカニズムによる場合とがあるが、短期間(2か月程度)における最大筋力の60%程度の中等度の負荷では、筋肥大ではなく主に神経系メカニズムによって筋力が向上するようである12)。ただし重要なのは、筋量の向上そのものではなく、生活するために必要とされる筋力が十分備わっているかという点である。Fiataroneらは、72から98歳のナーシングホームに入所する高齢者に対して最大筋力の80%のレジスタンストレーニングを10週間実施した結果、筋肥大は認められなかったが筋力の向上が認められ、歩行速度やバランス機能などの運動機能が向上することを証明した13)。
一方、筋肉や筋の機能は、つかわないことによって急激に低下することがよく知られており、トレーニングによって向上した筋肥大や筋力は、トレーニングの中断によってトレーニング前の状態へ戻る。また、寝たきり状態のように極端に筋肉をつかわない状態では、廃用性筋萎縮が生じる。たとえば、寝たきり状態を1か月間続けると大腿四頭筋の筋力は20%程度低下するため、短期間の入院により歩行困難となる高齢者の背景には、この廃用性筋萎縮が大きく影響している可能性が高い。
高齢者に対する下肢筋力トレーニングを実施した群と実施しなかった群のランダム化比較試験のメタアナリシス14)の結果(41研究、1,955名のまとめ)、下肢筋群の向上に対するStandardized Mean Difference(SMD)は0.68(95%信頼区間 0.52-0.84)となり、筋力トレーニングによって中等度以上の筋力向上が期待できることが明らかとされた。マシンを用いた高負荷レジスタンストレーニングと、エラスティックバンドなどを用いた軽度から中等度負荷のトレーニングを分けて分析すると、高負荷トレーニングの(32研究)SMDは0.81(95%信頼区間 0.60-1.01)、低強度から中等度トレーニング(9研究)のSMDは0.34(95%信頼区間 0.18-0.51)となり、両トレーニングともに筋力強化に有効であることが示された。ただし高負荷トレーニングが低負荷トレーニングと比較して有意に高い効果を認めている(SMD 0.51, 95%信頼区間 0.07-0.94)。トレーニング期間に関しては、その期間を12週間で分類して筋力トレーニングの効果を検討すると、両期間ともに筋力の向上効果が認められ、12週間を超えて継続した研究でより高い効果が認められた(<12週間: 25研究, SMD 0.62, 95%信頼区間 0.42-0.82; >12週間: 16研究, SMD 0.77, 95%信頼区間 0.50-1.05)。以上の結果から、筋力トレーニングは高齢者の筋力増強に効果的であり、その効果は高負荷レジスタンストレーニングや12週間以上のトレーニングによって得られやすい。ただし、高齢者においては筋力トレーニング以外の運動によっても筋力の向上が認められる点や、筋力以外の運動機能の向上全てに筋力トレーニングが有効であるわけではない。
また、身体的フレイルを有する高齢者に対する介入の効果として、栄養、身体的、認知的単独と複合介入の効果が明らかとされている15)。身体的介入は週2回の90分間の運動を12週間行い、その後12週間在宅での運動が推奨された。栄養介入はカルシウムとビタミン系のサプリメントが提供され、対象者は24週間毎日摂取した。認知的には記憶、注意、情報処理、問題解決能力をトレーニングするセッションが週2時間、12週間行われ、その後12週間は隔週で2時間のセッションが実施された。複合介入群は、これらすべてが実施された。その結果、12か月後のフレイルの有病率は、対照群でも15%減少したが、介入群において高い改善効果が認められた(36-48%)。フレイル改善に対する対照群と比較したオッズ比は、栄養介入2.98(95%信頼区間1.10-8.07)、認知的介入2.89(95%信頼区間1.07-7.82)、身体的介入4.05(95%信頼区間1.50-10.8)、複合的介入5.00(95%信頼区間1.88-13.3)の順に高く、すべて有意に高いオッズ比を示した15)。
4:認知障害に対する介入方法
認知機能低下や認知症に対しても、フレイルと同様に複合的な介入が実施されている。その中でも運動の実施とアルツハイマー病発症予防との関連は、縦断研究により多くの知見が報告されている。たとえば、認知機能障害のない1,740名の高齢者を平均6.2年間追跡調査した研究では、調査期間中に158名が認知症を発症し、これらの高齢者に共通した特徴が分析された。その結果、週3回以上の運動習慣を行っていた高齢者は、3回未満しか運動していなかった高齢者に対して、認知症になる危険がハザード比で0.62(95%信頼区間0.44-0.86)に減少したとされた16)。
健常高齢者を対象として運動介入による認知機能に対する効果を検討したシステマティックレビューをみると、運動の実施によって認知機能の向上は可能であるとした見解が得られているが17)、認知症予防の中心的な対象層である軽度認知障害(Mild Cognitive Impairment: MCI)を有する高齢者に対する運動の効果を検討したシステマティックレビューでは、言語流暢性検査においては、運動による有意な効果が確認されたが、その他の実行機能、認知処理速度、記憶について有意な効果が認められないとされた18)。ただし、よくデザインされた個々のランダム化比較試験の結果では、運動による認知機能の向上効果が多数認められており、今後、大規模なランダム化比較試験によって、その効果を確認していく必要がある。我々の研究グループでは、運動のみではなく、認知課題を同時に実施するコグニサイズを考案してMCI高齢者を対象としたランダム化比較試験を実施した。その結果、処理速度(Digit symbol coding)および言語能力(Word fluency test)の向上が認められた。また、健忘型MCI高齢者(n=50)に限定した分析では、全般的な認知機能(Mini mental state examination)の低下抑制、記憶力(Wechsler memory scale 1)の向上や、脳萎縮の進行抑制効果も認められた19)。これらの結果は、認知症予防のための取り組みとして運動を実施する場合に複合的な要素を取り込む必要性を示唆するものと考えられた。
また、運動とともに、食事、認知トレーニング、血管リスクのモニタリングといった複合的な介入を実施して認知機能に対する効果を検証した論文が報告された。対象者は、認知機能が年齢標準より軽度低下した高齢者1,260名(60-77歳)をランダムに介入群(631名)とコントロール群(629名)とに割り付け、介入群は定期的な食事指導と血管リスクのモニタリングと積極的な運動と認知トレーニングを実施した。運動は理学療法士がトレーニングジムにて個別指導を実施し、筋力トレーニングは週1-3回、有酸素運動は週2-5回実施している。認知トレーニングは10回のグループセッションと、パーソナルコンピュータープログラムを用いた72回の個別セッションを2回実施した。これらの予防対策を2年間実施した結果、神経心理学的検査バッテリーの総合点の変化に有意差が認められ、多面的介入の効果が示された20)。
5:COVID-19感染拡大防止下での介入
認知的フレイルを含めて、高齢者の健康増進のためには身体的、認知的、社会的活動をバランスよく生活の中に取り入れ、活動的なライフスタイルを身につけることが望ましい21)。活動的なライフスタイルの獲得においてICTの利活用が大きな役割を果たせるのではと期待が高まっている。例えば、通いの場や教室型の介護予防教室に参加しない高齢者や教室外の日常生活においてアプリケーションを利用した自己管理は介護予防に有効であると考えられる。特にCOVID-19の流行により直接交流をともなわない非対面下での介護予防の取り組みが必要である。
国立長寿医療研究センターではCOVID-19の感染拡大防止を図りながら、介護予防の取り組みを推進することを目的として「オンライン通いの場アプリ」と命名したアプリケーションを開発した(図3)。オンライン通いの場アプリは介護予防に役立つ情報の配信、身体的・認知的活動や外出を支援する機能、コミュニケーション機能、食事管理等をオンラインで自己管理しながら健康づくりに取り組めるアプリケーションである。オンライン通いの場アプリは、2020年度から約3,500名を対象としたランダム化比較試験により、要介護や認知症発症に対する抑制効果が認められるかどうかの介入試験を開始した。この研究を通して、アプリケーションによる予防の有効性が確認されれば、安価で誰もが簡単に実施できる予防のための方法を提示することが可能となる。今後、地域保健事業でデータの利活用ができるよう、管理者ツールを作成する予定となっており、自治体単位の申請で該当地域の登録者のデータを一括管理できるようになるので、介護予防事業として介入と効果検証ツールとしての活用を期待している。

6:まとめ
認知的フレイルに関しては、評価のための操作的定義に関しての国際的なコンセンサスが得られているとは言い難い状況にあり、これが研究の推進を阻害している。暫定的ではあるものの、日本のコホート研究のデータベースから認知的フレイルを操作的に定義して、健康状態との関連性を調べた結果、認知的フレイルは認知症発症と関連することが確認された。身体的問題と認知的問題の発生には、共通した病理や機能的な変化と、それぞれの症状に独立して関連する要因とが存在すると考えられ、これらの要因を明らかにしていくことで総合的なフレイル対策が可能となるだろう。また、身体的フレイルと認知障害それぞれに対する介入方法は多くの研究があるものの、認知的フレイルに対する介入研究は緒についたばかりであり、研究を推進する必要がある。
文献
プロフィール

- 島田 裕之(しまだ ひろゆき)
- 国立長寿医療研究センター
老年学・社会科学研究センター長 - 最終学歴
- 2003年 北里大学大学院医療系研究科臨床医学リハビリテーション医学専攻博士課程卒
- 主な職歴
- 2003年 東京都老人総合研究所研究員 2005年 Prince of Wales医学研究所客員研究員 2006年 東京都老人総合研究所研究員 2010年 国立長寿医療研究センター室長 2014年 同・予防老年学研究部長 2015年 名古屋大学未来社会創造機構客員教授(現在兼任)、信州大学大学院総合医理工学研究科客員教授(現在兼任) 2019年 国立長寿医療研究センター老年学・社会科学研究センター長(現職)、同志社大学研究開発推進機構客員教授(現在兼任)
- 専門分野
- 老年学
- 所属学会
- 日本老年医学会(評議員)、日本サルコペニア・フレイル研究会(世話人)、日本認知症予防学会(評議員)、日本予防理学療法学会(代表幹事)、理学療法科学学会(評議員)、日本転倒予防学会(評議員)、日本介護予防・健康づくり学会(理事)、日本認知症学会
- 社会活動
- 2013年から BMC Geriatrics(共同編集者) 2013年から BioMed Research International(編集委員) 2018年から Journal of Clinical Medicine(招聘編集者)
