各論1 様々な臨床病態とフレイルの関連 3.腎不全におけるサルコペニア:病態と対策
公開月:2021年9月
東名厚木病院 名誉院長
慢性腎臓病研究所 所長
冨田 公夫
1:はじめに
一般に、筋肉が減少する病態をサルコペニア(sarcopenia)と言う。ギリシャ語でサルコ(sarco)は「肉・筋肉」、ペニア(penia)は「減少・消失」であり、加齢や老化に伴う筋力の低下を意味していたが、現在では、慢性腎臓病(CKD)などの慢性疾患による筋肉減少にも用いられている。筋力の減少は、健康成人においても、骨折のリスク因子であり、高齢者ではそのまま寝たきりになって、生命予後に直接関連することで重要なテーマとなっている。
CKD患者では運動不足になりがちであり筋肉量が減少するが、腎機能の低下による代謝異常が筋肉の蛋白合成を減少させていることも示されている。近年、筋肉より多種のサイトカインが分泌され、マイオカイン(myokine)と総称されているが、遠隔他臓器への種々の作用が示されている。腎臓においてもこのサイトカインの影響下にある。この中で筋肉由来のサイトカインが腎機能を保護していることも示され、筋肉を保つことは運動能を保つだけでなく腎機能を改善する積極的な役割を持つ可能性がある。これは「筋腎連関」として注目されている。本稿では、CKD患者における実態、筋肉減少の機序、運動による筋肉増強の腎保護作用などについてまとめた。
2:CKD患者のサルコペニアの頻度、運動不足、予後
CKDにおけるサルコペニアの頻度は非透析患者で5.9-15.4%、透析患者で13.7-33.7%との報告がある1-4)。本邦の成績でeGFR 60mL/min/1.73m2未満のCKD患者で25%がサルコペニアであった5)。透析導入期の末期腎不全患者では70%という成績もあり高頻度であることが示されている6)。
透析患者の運動量を検討した成績によると、レジャーの時に運動するか否かというアンケート調査では、日本ではほとんどしない人が40%と多く、週に2-3回が20%、毎日運動するが15%ほどであった。アメリカ、カナダも同様であった。一方、ドイツ、イタリアはほとんどしないが80%であった7)。
このように透析患者は、運動量の少ない生活様式になっているが、その中でも、活動的な人は座りがちな人に比べ、生存率が良いという成績がある8)。学歴、雇用、独居、肥満、心不全、血管障害、などの背景因子には関係なく運動の有用性が示されている。歩行できなくても他の筋肉の運動の有用性も認められている7)。サルコペニアを合併したCKD/末期腎不全患者では、心血管病、死亡、入院リスクが2-3倍増加している9)。
3:CKD患者の筋肉減少の機序
分解された蛋白は新たな蛋白に常に置き換えられている。体重70kgの人では1日およそ280gの筋肉が交換され一週間で置き換わる。この蛋白合成と分解のバランスが負になると、筋肉量の減少がおこる。
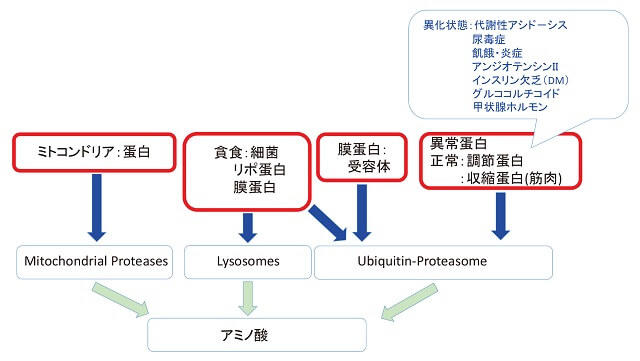
1.蛋白分解系路(図1)
CKD患者では、基礎に運動不足から筋力・運動能が低下しているのに加え蛋白分解系の亢進が示されている。
古くより、ミトコンドリアで蛋白分解が起こっていることが知られ、また細菌の貪食作用にlysosomeによる蛋白分解が知られている。膜蛋白の受容体の調節にubiquitin-proteasome(U-P系)がよく知られているが、このU-P系は、異常蛋白処理、さらには、調節蛋白、筋肉などの処理に関与している。収縮筋肉の分解を促進するものとして、代謝性アシド-シス、尿毒症、飢餓、炎症、アンジオテンシンII(ATII)、インスリン情報伝達系の異常10)、ホルモン異常、などが主なものとして挙げられている11)。腎不全では、代謝性アシド-シス、尿毒症物質、などによるインスリン抵抗性も示されており、さらに糖尿病腎症においては、インスリン欠乏に加え、腎不全に伴う代謝異常によるさらなる筋力減少が推測される。
1)U-P系(図2)
蛋白分解系のU-P系は、ubiquitin活性化酵素(E1)、ubiquitin結合酵素(E2)、ubiquitin転移酵素(ubiquitin ligase)(E3)の3つの酵素によって構成され、蛋白を分解する。ubiquitin ligaseはatrogin-1(atrophy gene-1)、MuRF-1(muscle RING finger protein-1)などが重要である。これらを刺激する因子として、筋肉には転写因子FOXO1、3a、4(Forkhead box、A-Sの16個のサブファミリーがある)の3種類があり、敗血症モデルでFOXO1がatrogin-1を刺激し、飢餓モデルではFOXO3aがatorogin-1を、またTNF-α(Tumor Necrosis Factor)がFOXO4を介してatrogin-1を刺激することなどが示されている。炎症時に増加するサイトカインとしてIL-6(Interleukin-6)、さらにmicroRNAなどが調節因子として注目されている。
筋肉特異的に、FOXO1をノックアウト(KO)した、CKDマウスでの成績(70%の腎臓を摘出。3ヶ月後)では、FOXO1、U-P系を介して、筋肉の分解が起こる可能性が示されている12)。
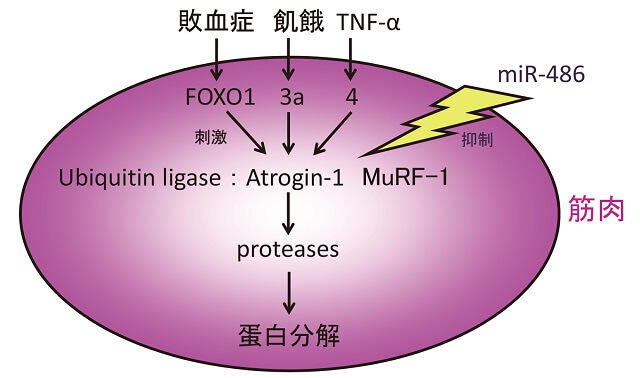
黒矢印:刺激、ギザギザ矢印は抑制.
FOXO(Forkhead box), Atrogin-1(atrophy gene-1), MuRF-1(muscle RING finger protein-1)
腎機能障害では酸排泄障害によりアシドーシスが出現する。このアシドーシスによる筋萎縮はU-P系の亢進によることが示されている13)。
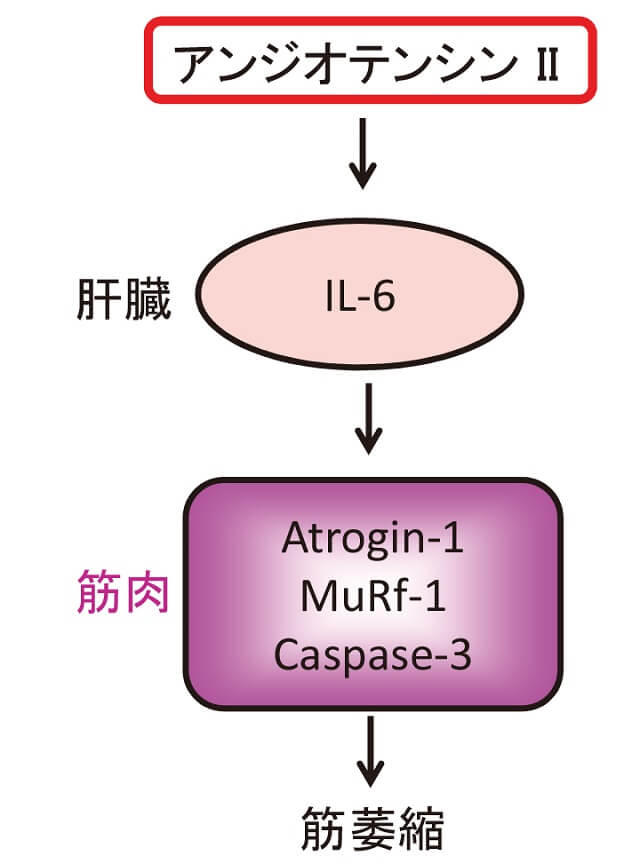
サイトカインは、尿毒症、敗血症等いろいろな病態で出現し代表的なものに、IL-6(Interleukin-6)があるが、アンジオテンシンII(ATII)によってもサイトカインが産生される14)。ATIIは受容体に結合して生理作用をおこすが、その際、酸化ストレスを発生しその過程でサイトカインが生ずる。正常では一酸化窒素(NO)やsuper oxide dismutaseなどにより無毒化されるが、過剰状態では臓器障害を起こす。マウスにATIIをosmotic mini-pumpで7日間投与すると(血圧は上昇)、種々のサイトカインが発生し、なかでもIL-6が著明に増加し、筋肉は萎縮する。コントロールマウスとIL-6KOマウスの前脛骨筋、ヒラメ筋での比較検討した成績で、IL-6KOマウスでは、コントロールと同様の筋所見を示しており、ATIIによる筋肉の萎縮はみられなかった。またATIIによりコントロールマウスでatrogin-1、MuRF-1の上昇が見られ、IL-6KOマウスで低下し、caspase-3陽性線維は、IL-6KOマウスでは増えていない。これらより、ATIIはIL-6を増加させ、atrogen-1、MuRF-1、caspase-3などを増加させ、筋萎縮を生じると考えられる(図3)。
2.蛋白合成経路(図4)
1)IGF-1:Insulin-like Growth Factor-1(インシュリン様成長因子-1)
主に成長ホルモン(GH)による刺激により肝臓から分泌される。蛋白質の摂取は、総カロリー消費とは無関係にIGF-1のレベルを上昇させる。
人において、加齢と血清IGF-1濃度をアメリカ、イタリアのデータ比較した成績によると、加齢と共に全体として低下していくことがわかる15)。
IGF-1の受容体欠損マウス(IGF-1RKO:IGF-1 receptor knock out mouse)を用いて、IGF-1の筋肉再生、肥大の関与を検討した成績がある16)。片腎摘出+残りの半分の腎を摘出したCKDマウスで、コブラ毒投与後では、TGF-β(Transforming Growth Factor-β)が増加するが、CKD:IGF-1RKOマウスではさらに筋肉の再生が傷害され、TGF-βの繊維化も増加していた。CKD状態でもIGF-1の減少が筋萎縮に関与していることがわかる。
若いマウスに、IGF-E1aを遺伝子導入し筋肉量を検討すると17)、6ヶ月後の筋肉量、筋肉の強さは15%増加した。高齢マウスを27週後に比較すると、筋肉は減少しておらず、加齢によるサルコペニアが抑制されていた。
これらより、筋肉の合成・生成系としてのIGF-1-Akt(protein kinase B)系が重要であり、細胞内で、相互にネットワークを構成している事がわかる。
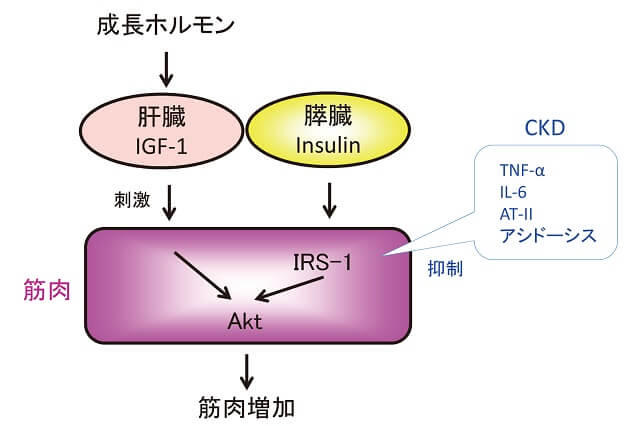
IGF-1:Insulin-like Growth Factor-1, IRS-1(Insulin Receptor Substrate-1), Akt(protein kinase B),TNF-α(Tumor Necrosis Factor), IL-6(interleukin-6), ATII(アンジオテンシンII)
2)インスリン
インスリンは、蛋白同化ホルモンでもあり、不足により、筋肉合成が減少し、糖尿病では筋肉量の減少が知られている。CKDでは軽度の腎機能障害時より糖尿病でなくてもインスリン抵抗性が認められている18)。
CKDでは、TNF-α、IL-6、IFN-γ(interferon-γ)、LPS(lipopolysaccharide)などのサイトカインの上昇が認められている19、20)。TNF-α、IL-6などのサイトカインは筋肉のインスリン受容体、IRS-1(Insulin Receptor Substrate-1)のリン酸化を阻害しインスリン作用を抑制し筋肉量を減少させる21、22)。尿毒症物質のインスリン抵抗性の機序については、チロシンの代謝産物であるp-cresolの複合体p-クレシル硫酸(p-cresyl sulfate: PCS)での報告がある23)。p-クレシル硫酸により筋肉内の酸化ストレスが増加し、セリン-スレオニンキナーゼが活性化されインスリン抵抗性が起こる。
腎機能の低下とともにレニン-アンジオテンシン系の亢進があり、ATIIの増加もインスリン抵抗性に関与していることが示されている。ATIIはIL-6、アミロイドA産生を増加させ、そのためIRS-1が減少し、インスリン作用が減弱するという機序も考えられている24、25)。腎機能の低下時は血中のアルドステロン濃度の上昇も認められており26、27)、アルドステロン受容体の活性化とNO合成酵素阻害物質のジメチルアルギニン(ADMA)の増加によりインスリン抵抗性が生じる。アルドステロン拮抗薬のスピロノラクトン投与により、インスリン抵抗性改善とADMA濃度の低下が認められている。
腎機能低下により酸排泄が低下し、代謝性アシド-シスを呈するが、U-P系の異常に関連した機序によるものか、さらに別の機序によるものか詳細は不明だがインスリン抵抗性を引き起こす28)。
3)microRNA
近年、microRNAによるmRNAの転写抑制、mRNAの分解促進など、多くの報告がある。microRNA-486(miR-486)が筋肉増強に関連するAkt signalを調節しているという報告もある。マウス培養筋細胞で、デキサメサゾン処理による筋肉の分解量を検討したもので、フェニルアラニンのC14を標識させておき、その分解産物を測定し、筋肉の分解量を測定した成績では、コントロールに比べ、miR-486をtarnsfectさせたものでの筋肉分解量の低下が示された12)。CKDモデルにmiR-486を、electroporationにより、前脛骨筋に導入して検討したものでは、miR-486の遺伝子導入により、筋萎縮が起こらず、保護効果が示された。miR-486の遺伝子導入により、筋肉のユビキチンリガーゼのatrogin-1、MuRF-1の抑制が認められる(図2)。AktのネガティブレギュレーターのPTEN(phosphatase and tensin homolog)は減少し、FOXO1も減少し、筋肉を増加させるAktが増加している12)。これらより、筋肉増加が推測される。
4:酸補正、運動による腎保護作用、生命予後の改善
1.アルカリ製剤の投与
腎機能障害が進行すると食物の代謝産物の酸が貯留しアシドーシスになる。食事は日々の変化が多く食事による酸負荷が腎機能に与える影響は、薬による効果の検討と異なり、検討方法が難しく報告はあまりない。低蛋白の食事療法をきちんと施行している217例で、血清HCO3-が正常域に保たれている患者の、食餌中酸負荷量をNet Endogenous Acid Production(NEAP)=54.5×「蛋白摂取/K排泄」−10.2で計算し、4分画し、酸負荷量の少ない群を1、徐々に多い群を4と分けて、eGFR 25%異常の悪化、もしくは透析への移行を腎死亡としてKaplan-Meier分析したものでは、食事中の酸が多いほど、早く腎機能低下が進行するという成績がある29)。酸血症になっていなくとも、酸負荷により腎機能が低下しやすいという成績である。血中HCO3-レベルで比較した成績でも、コントロール群に比べ、HCO3-の低い群の方が腎機能障害の進行速度が高いことが示されている30)。
酸負荷により腎障害が起こっている可能性が考えられるが、筋肉でどのようなことが起こっているのかについての検討で、CAPD(continuous ambulatory peritoneal dialysis)患者8名で、アシドーシスの補正と、筋肉のubiquitin mRNA量を検討したものでは、4週間の補正によりubiquitin mRNAの減少が示唆されている31)。クレアチニンクリアランス15-30mL/min/1.73m2、血清HCO3-16-20mmol/Lの患者で、重炭酸ナトリウムの投与により代謝性アシドーシスを改善することにより腎機能の低下速度の抑制が示されている32)。
2.運動(図5)
運動によるメリットの一つに、抗炎症作用がある。30分以上の歩行を週5回、6ヶ月した群とそうでない群において、試験管内での黄色ブドウ球菌毒素(staphylococcal enterotoxin)刺激によるT cell:CD69、CD86の発現量の比較成績で、初期活性化マーカーのCD69、副刺激分子のCD80/CD86などを指標にして比較すると、運動グループでは低下していて、サイトカインの発生が少ない可能性が示唆されている33)。
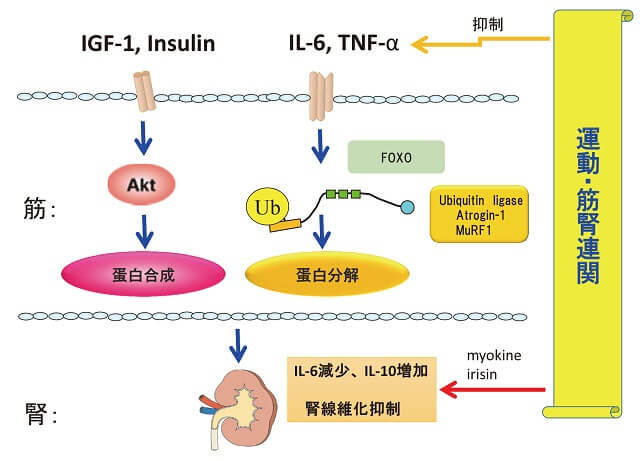
炎症性サイトカインとしてIL-6、炎症抑制性サイトカインとしてIL-10を測定し、その比を指標として検討した成績で33)、運動グループの血漿IL-6は低下傾向、IL-10は上昇傾向を示し、比でみると、コンロ-ルグループは不変であったが、運動グループで有意の低下が示された。これより、運動により炎症性サイトカインの放出量が低下し、筋肉の分解が減少する可能性が考えられる。
運動による腎機能の改善が、炎症性サイトカインの減少に加え、心機能改善や血圧の改善などによる可能性も無視できないが、骨格筋の増強自体と腎機能について検討するために、筋肉を強制的に増加させたマウス、尿細管結紮線維化モデル(UUO)での成績がある34)。筋肉特異的なAkt1トランスジェニックマウスを用い、運動とは関係なく筋肉を増強させた成績である。Akt1活性化後7日、UUOモデルを作成し、骨格筋から離れた腎臓の尿細管の線維化の程度を比較すると、Akt1トランスジェニックマウスにおいて、尿細管の障害が軽度であった。尿細管のコラーゲン1、3、TGF-β(Transforming Growth Factor-β)、CTGF(Connective Tissue Growth Factor)などの線維化促進因子、フィブロネクチンなどの線維化も軽度であった。更に、マクロファージ、炎症マーカーのIL-6、IL-1β、TNF-α、MCP-1(Monocyte Chemotactic Protein-1)、ICAM-1(Intercellular Adhesion Molecule 1:細胞接着分子1)、VCAM-1(Vascular Cell Adhesion Molecule-1)などいずれも低値を示した。筋肉より体液因子が放出され、腎臓に到達し、保護作用を持った可能性が考えられる。筋肉のAkt1活性化をもたらす血中サイトカインについて検討すると、腎保護作用が考えられるサイトカインのIL-2、-10、-17が増加していた。また、血漿adiponectin濃度の低下も認められた。これも腎繊維化抑制に関与した可能性がある。IL-10、-17は、eNOS(Endothelial Nitric Oxide Synthase)を刺激することが知られているのでNOSに作用した可能性についてL-NAMEを用いて検討すると腎臓のeNOSのシグナルを増加させることによる腎保護作用が推測された。
最近の研究で、irisinという物質が候補として上がっている35)。Peroxisome proliferator-activated receptorγcoactivator-1α(PGC-1α)は転写因子PPARγに結合する転写コアクチベーターとして同定された分子で、エネルギー産生や熱消費に関わる多くの遺伝子発現を制御し、ミトコンドリア生合成を増強させる。骨格筋にPGC-1αを強発現したマウスでは、いくつかのサイトカインが増加し、その中のirisin(12.4kDa)というサイトカインは、葉酸による腎障害モデルでの尿細管のエネルギー代謝を改善し、腎障害を回復した。PGC-1αマウスではアポトーシスが少なく、caspase-3は有意に抑制されていた。またSmad2/3も有意に抑制されていた。TGF-βと拮抗することにより腎線維化を抑制したと考えられる。recombinant irisinの投与により、TGF-βの受容体の活性化を抑制し、Smad2/3のリン酸化が抑制されることも示されている。
保存期CKD患者、血液透析患者での運動療法は腎臓リハビリテーション学会で推奨されている36)。日本では、保存期、透析期を含め、CKD患者に対する確立された運動療法はまだない。有酸素運動として、嫌気性代謝閾値(運動時に有酸素運動から無酸素運動へと切り替わる運動強度の閾値)を保ちながら、脈拍などを目安に、歩行、走行、サイクリングなど持久運動を行う。続けてあるいは休みを入れながら1回につき20-60分、1日あたり1-2回、週3-5日が推奨されている。日常生活で加わる以上の抵抗(レジスタンス)を筋肉に与え、筋力、筋持久力などの筋機能を高める運動をレジスタンストレーニングといい、筋力増強には有用である。
運動により透析患者でも、体力増強が認められるという報告がある。30分以上、週3回、3-6ヶ月で平均17%の増強を認めている。日本からの成績も含まれている37)。
保存期のeGFR平均45mL/分ほどの患者20例の成績で、有酸素運動とレジスタンストレーニングを週3日行い、腎機能の低下が改善したという報告もある38)。
3.栄養
ステージG3b以上では、0.6-0.8g/kg/日の蛋白制限が推奨されているが、サルコペニアを合併している場合には、実際の食事摂取量の再チェックが必要であり、低栄養になっていないか、蛋白制限緩和を含めて判断する必要がある39)。
文献
プロフィール

- 冨田 公夫(とみた きみお)
- 東名厚木病院 名誉院長
慢性腎臓病研究所 所長 - 最終学歴
- 1973年 東京医科歯科大学医学部卒
- 主な職歴
- 1982~85年 米国国立衛生研究所(NIH)留学 1990年 東京医科歯科大学第二内科学教室助教授 1994年 熊本大学第三内科学教室教授 2003年 熊本大学大学院医学薬学研究部腎臓内科教授(組織改組) 2013年 熊本大学名誉教授、東名厚木病院名誉院長、慢性腎臓病研究所所長 現在に至る
- 専門分野
- 腎臓内科学、透析療法、高血圧
- 主な著書
- 「腎臓病学への招待」日本医学出版、「高血圧の治療と食事療法」日東書院、「症例から学ぶ腎臓病学」東京医学社
