第4章 認知症の予防 2.生活習慣病 (2)高血圧
公開月:2019年10月
大阪大学大学院医学系研究科内科学講座(老年・総合内科)助教
鷹見 洋一
大阪大学大学院医学系研究科内科学講座(老年・総合内科)教授
樂木 宏実
1.はじめに
高血圧を含む生活習慣病は加齢とともに罹患率が増加する血管性認知症の危険因子であるが、アルツハイマー病(AD)の発症にも関与していることが分かっており、重要な修正可能な危険因子の一つである。また、ADには脳血管病変の合併が多く、高血圧との関連が強いことが報告されている1,2)。本稿では認知機能低下や認知症発症の予防の観点から、高血圧との関連についての現状での臨床的なエビデンスについて概説する。
2.高齢者高血圧
高血圧有病率は加齢とともに増加し、本邦の国民健康・栄養調査(2015年)によれば、65-74歳の63%、75歳以上では74%が高血圧に罹患している。また高血圧は高齢者のQOLや予後の重要な予後規定因子である脳 心血管疾患の発症に大きく関わる。また、高齢者は身体的、精神的、社会的背景が多様で個人差が大きく、多病であり、症状も非典型的であるため、降圧治療に際しては個別の対応が要求される。従って、高齢者高血圧の治療方針の決定については個々の患者が有するこれらの多くの背景因子を総合的に判断して個別に慎重な治療方針の決定を行う必要がある。現在、日本高血圧学会では高血圧治療ガイドラインの改訂(JSH2019)が行われているが、現行の日常診療における高齢者高血圧の治療においてはJSH2014や2017年に日本老年医学会から発表された高齢者高血圧診療ガイドライン(JGS-HT2017)で示された指針が有用である。JSH2014では、HYVET研究での実薬群の到達血圧などから3)、原則75歳未満の降圧目標を140/90mmHg 未満、75歳以上の降圧目標を150/90mmHg未満とし、忍容性があれば140/90mmHgを目指すとしている。後述するSPRINT研究の結果は忍容性があれば140/90mmHgを目指す推奨を支持する結果であるが4)、忍容性を判断する明確な基準は存在せず、フレイルや認知症の有無、降圧薬による有害事象の有無など、高齢者特有の様々な因子を総合的に分析して判断すべきであり、過度の降圧によるデメリットにも十分な注意を払うことが必要である。このように高齢者の併存疾患として頻度の高い認知症の存在は高齢者高血圧を治療する上でも考慮すべき重要な要素である。
3.高血圧と認知症発症、認知機能低下
高血圧は脳血管の構造的、機能的異常を来し、血管性認知症(VaD)の重要な危険因子であることは周知のことである。しかし、認知症の過半数を占めるADと高血圧の関連については依然不明な点が多く、年齢、高血圧の罹患期間、降圧薬等が関連しており、複雑である5,6)。中でも、年齢の影響が強く、若年期の高血圧は中年期の認知機能低下と7)、中年期の高血圧は高齢期の認知機能低下の危険因子になる可能性が多数の観察研究で知られている5,8,9)。
中年期の高血圧と認知症発症、認知機能低下について検討したものとして、フィンランドからの報告では、中年期(平均年齢50歳)の認知症を有さない住民を平均71歳時に再調査したところ、認知症を発症していた集団では中年期の収縮期血圧が有意に高かったが、再調査時の血圧は非発症群と同等であったという研究結果がある10)。また、日系人男性(45~68歳)を対象としたホノルル・アジア研究では、中年期(初回調査時)での収縮期血圧が160mmHgを越える群では、再調査時の認知機能低下リスクが2倍以上であったが、再調査時の高血圧は認知機能低下リスクにならず、収縮期110mmHg未満の低血圧が認知機能低下と関連していた11)。同研究では中年期の高血圧がAD発症のリスクとなるかについて種々の方法を用いて検討を行なっている。243例の剖検から評価した検討では中年期の拡張期高血圧はADに特徴的な海馬での神経原線維変化沈着のリスクを2倍以上増加させた。また再調査時のMRIを用いた検討で中年期の拡張期高血圧は高血圧性脳病変(ラクナや白質病変)を交絡因子として補正しても海馬萎縮の危険因子であった12)。さらにADの遺伝的危険因子となるApoEε4アリルと中年期の収縮期高血圧(>160mmHg)を同時に有すると認知機能低下のリスクが10倍以上になることが報告されている13)。
米国で正常認知機能の47歳から89歳の118人を対象としてアミロイドPETで評価したAβ沈着と血管性危険因子の関連を検討した研究が行われた14)。その結果、ApoEε4アリルを有さない群では高血圧は皮質Aβ沈着に影響を与えなかったが、ApoEε4アリルを有する群では無治療の高血圧は皮質Aβ沈着を増加させ、またApoEε4保有者において脈圧と皮質Aβ沈着に正の相関を認めたと報告されている。与えなかったが、ApoEε4アリルを有する群では無治療の高血圧は皮質Aβ沈着を増加させ、またApoEε4保有者において脈圧と皮質Aβ沈着に正の相関を認めたと報告されている。
一方で、中年期の高血圧とADの関連について否定的な報告もあり、久山町研究では、中年期の高血圧は老年期の血圧値に関わらず認知症を増加させたが、病系を分類すると中年期の高血圧はVaDを増加させるが、ADとは関連しないことが示されている9)。
高齢期における高血圧と認知症との関連については一定した報告がない。スウェーデンからの報告で70歳の非認知症住民を15年間追跡した研究では、85歳時に認知症を発症していた群で70歳時の血圧が有意に高かったが、ADとVaDに分類した検討では、ADでは70歳以降経時的に血圧が低下し85歳時には非認知症患者より収縮期血圧が低かった(図1)15)。但し、同研究における両者の鑑別は画像診断に基づくものでなく解釈には注意を要する。他の報告でも高齢期の高血圧のみならず、低血圧も認知症と関連している可能性を示す報告があるが16,17)、高齢期の血圧と認知症との関連について一定しない理由として、中年期の血圧と高齢期の血圧との交互作用が影響している可能性があり、更なる検討を要する2,18)。
以上の結果からは、高血圧は認知症を発症していない時期、特に中年期においてその後の認知症発症のリスクになることが考えられる一方、高齢期においては高血圧と認知症発症との因果関係は不明であり、低血圧が認知機能低下と関連している可能性もある。また、中年期や高齢期の年齢の定義は明確ではなく、どの年齢までの高血圧が認知症の危険因子となるのかは不明である。
更には、我が国の大迫研究や久山研究から一方で、中年期の高血圧とADの関連について否定的な報告もあり、久山町研究では、中年期の高血圧は老年期の血圧値に関わらず認知症を増加させたが、病系を分類すると中年期の高血圧はVaDを増加させるが、ADとは関連しないことが示されている9)。
高齢期における高血圧と認知症との関連については一定した報告がない。スウェーデンからの報告で70歳の非認知症住民を15年間追跡した研究では、85歳時に認知症を発症していた群で70歳時の血圧が有意に高かったが、ADとVaDに分類した検討では、ADでは70歳以降経時的に血圧が低下し85歳時には非認知症患者より収縮期血圧が低かった(図1)15)。但し、同研究における両者の鑑別は画像診断に基づくものでなく解釈には注意を要する。他の報告でも高齢期の高血圧のみならず、低血圧も認知症と関連している可能性を示す報告があるが16,17)、高齢期の血圧と認知症との関連について一定しない理由として、中年期の血圧と高齢期の血圧との交互作用が影響している可能性があり、更なる検討を要する2,18)。
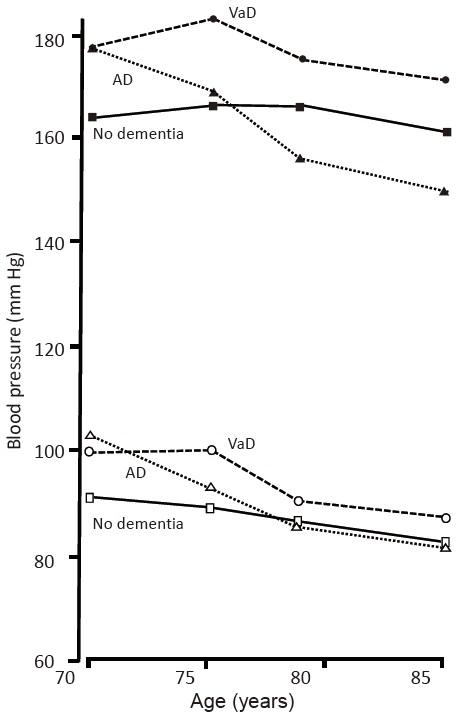
(Skoog I, et al., 199615)より引用)
以上の結果からは、高血圧は認知症を発症していない時期、特に中年期においてその後の認知症発症のリスクになることが考えられる一方、高齢期においては高血圧と認知症発症との因果関係は不明であり、低血圧が認知機能低下と関連している可能性もある。また、中年期や高齢期の年齢の定義は明確ではなく、どの年齢までの高血圧が認知症の危険因子となるのかは不明である。
更には、我が国の大迫研究や久山研究から血圧変動と認知機能低下や軽度認知機能障害との関連を示唆する報告もあり、起立性低血圧やDay-to-Dayの血圧変動の増加もリスクである可能性がある19,20,21)。
4.降圧薬治療の認知症発症、認知機能低下への効果
中年期の高血圧への降圧療法はその後認知症発症を抑制する可能性が高いと考えられるが、長期にわたる試験が困難なため介入研究では証明されていない。観察研究では中年期からの降圧療法が高齢期の認知症発症を抑制することを示唆する結果が示されているため、中年期の高血圧治療は従来通り、将来の認知症発症の抑制の面からも積極的に行うべきである22,23)。
高齢期における降圧療法が認知症発症に影響するかどうかについてはまだ明らかでない。長期縦断観察研究のメタ解析では、降圧薬服用者では認知症の発症リスクが低いことが示されているが、認知機能障害や認知機能低下に対しては効果がなかったとの報告がある24)。重要な大規模臨床試験として、SHEP研究(利尿薬±β遮断薬)、SCOPE研究(ARB±利尿薬)、PROGRESS研究(ACE阻害薬±利尿薬)、HYVET研究(利尿薬±ACE阻害薬)があり、いずれも認知症発症の抑制効果を認めていない。また、HYVET、SCOPE、SHEP、Syst-Eurの4試験を解析対象としたメタ解析においても、実薬群による認知症発症予防効果は認められなかった25)。また、脳血管障害の既往を有さない高血圧患者を対象としたプラセボ対象RCTのメタ解析では、降圧薬投与は認知機能を有意に改善したが、脳血管障害既往者を含むメタ解析では有意な効果は認められていない。またプラセボ対象RCTのメタ解析では、降圧薬による認知症発症抑制効果は示されていない。一方、降圧療法によって認知症発症を抑制したとする研究にはSyst-Eur研究が(Ca拮抗薬±ACE阻害薬±利尿薬)があり、実薬群でAD発症が50%抑制されている26)。同研究において二重盲検プラセボ比較終了後より両群に降圧療法を施行したところ、当初から降圧治療を開始された群では認知症発症のリスクがプラセボ群より降圧薬治療が行われた群に比して55%軽減されていた(P<0.001)。また、HYVETに、SHEP、Syst-Eur、PROGRESSの3試験を加えたメタ解析では、実薬群が認知症発症を優位に抑制することを示している(図2)27)。
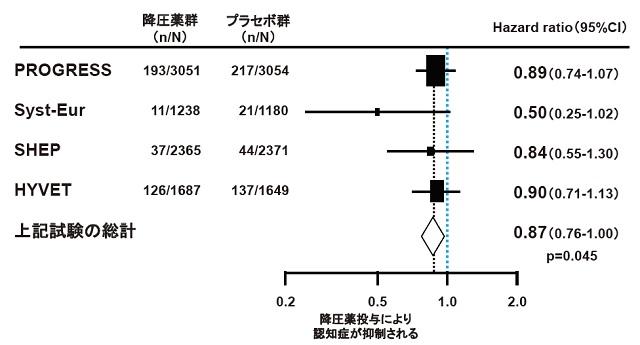
(Peters R, et al., 200827)より引用)
以上より、高齢者における降圧療法の認知症抑制効果の結果は一定しておらず、現在では明確な結論は得られていない。これには統計学的パワーが低いことや、追跡期間が不十分であること、認知症評価法などの方法論的な問題も原因として考えられる8)。ただし、降圧薬治療が認知症発症を増加させるエビデンスもなく、少なくとも脳卒中による認知症発症を抑制することは明らかであることもあり、心血管病の予防の面からも高齢者における降圧薬治療は行われるべきであると考えられる。
5.高血圧と認知症発症、認知機能低下
認知機能低下を有する高齢高血圧患者を対象とした、降圧治療に関する研究は少なく、エビデンスが少ないのが現状である。JSH2014においては合併疾患や高齢者高血圧に準拠した降圧を行うことが推奨されている。
まず、軽度認知機能障害(MCI)についての研究として以下のようなものがある。MCIから認知症への進展に対する高血圧の影響を検討した2つのメタ解析では、高血圧は有意なリスクとはならなかったが28)、中国からの横断研究では、高血圧を有する群が有意にMCIの頻度が高く、血圧がコントロールされている者や降圧薬治療を受けている者ではMCIの頻度が低いとの報告もある29)。また、降圧治療がMCIからADに進展するのを予防したとの観察研究や降圧薬治療中のMCI患者の観察研究において、中枢作動性ACE阻害薬とARB使用者が認知症への進展を有意に軽減し、認知機能の低下も抑制したという研究もある30)。高血圧の積極的なコントロールは考慮すべきと考えられる。
認知症、特にADを合併する高血圧患者の降圧治療が認知機能へ与える影響を検討した報告も限られている。ADに対して、降圧薬を含む動脈硬化の危険因子の加療により認知機能低下が抑制されたと報告されている31)。AD患者の追跡研究において降圧薬服用者は、非服用者に比し認知機能低下が少なかったという報告もある32)。降圧薬の種類については、レニン・アンギオテンシン系阻害薬によりADの認知機能低下が抑制されたと報告されている33,34)。認知症を合併する高血圧患者の治療開始基準に関するエビデンスも少ないが、MCIとADを対象とした観察研究において、降圧薬服用例では昼間の血圧低値群(昼間血圧128mmHg以下)で認知機能の低下が有意に促進していたとの報告がある。過降圧による脳血流低下が、認知機能悪化を来す可能性が示唆されたが、降圧薬治療を中止しても認知機能には改善は認められなかった35)。
以上の結果から、MCIを含む認知機能障害のある高齢高血圧患者に対する降圧治療が、その後の認知機能悪化を抑制することを示唆する報告があるが、エビデンスレベルは低く結論は現状ではできない。また、過降圧と考えられる血圧コントロール状況は認知機能低下と関連する可能性が高いことにも注意が必要であることも重要である。高度の認知症患者に対しては、降圧薬療法のエビデンス自体が乏しく、臨床研究からはどのように血圧管理をすべきか言及が困難である。
6.SPRINT MIND(Memory and Cognition IN Decreased Hypertension)
JSH2014以降に発表された重要な大規模臨床試験としてSPRINTが挙げられる。SPRINTは糖尿病、脳梗塞の既往のない患者に対する積極治療(収縮期120mmHg未満)と標準治療(収縮期140mmHg未満)が心血管イベントや予後に及ぼす影響を比較検討した研究である4)。同研究では積極治療が標準治療に比べて心血管イベントや予後を改善させることが早期に示されたため、平均5年の追跡期間を3.2年に短縮して打ち切られたが、PRINTにおける積極治療の優越性は75歳以上においても認められている36)。但し、SPRINTではAutomatedoffice blood pressure(AOBP)という患者自身が静かな部屋で自ら血圧を測定する方法が用いられており、通常の診察室血圧測定法とは異なる。また、SPRINTのような大規模臨床試験においては介護施設入所者や認知症患者等、高度に機能の低下した高齢者が参加しておらず、糖尿病患者、脳卒中既往患者を含まない事から同試験の結果を全ての高齢者に当てはめることはできないが、SPRINT試験の参加者の半数はMCIを有しており、MCIや認知症に対する厳格降圧の影響を示すSPRINTのサブ解析であるSPRINT MINDの注目すべき予備調査結果の学会報告がある。概要としては積極治療群では標準治療群に比較して、MCI新規発症率が19%低く(P=0.01)、更にMCIと認知症を合わせた発症率は積極治療群では標準治療群より15%低かった(P=0.02)というものである。高齢者における高血圧治療の認知症に対する影響がより明確になる可能性があり、正式な論文発表が待たれるところである。
7.おわりに
高血圧の認知機能低下や認知症に与える影響は依然、更なる検討が必要と考えられるが、中年期の高血圧は認知症の危険因子であり、積極的に治療すべきことは十分なエビデンスがあり、間違いないものである。高齢者における降圧治療の認知症発症予防については前述のSPRINT MINDなど今後の研究でより明確になることが期待できる。認知症は日本だけでなく、全世界レベルで増加しており、本稿で概説したような臨床的研究とともに根本的な治療を目指した基礎的アプローチも今後、更に需要が高くなることは必然と考えられる。
文献
プロフィール

- 鷹見 洋一(たかみ よういち)
- 大阪大学大学院医学系研究科内科学講座(老年・総合内科)助教
- 最終学歴
- 2007年 大阪大学大学院医学系研究科卒
- 主な職歴
- 1998年 大阪大学医学部附属病院研修医 1999年 国立大阪病院(現大阪医療センター)研修医 2000年 国立循環器病センター(現国立循環器病研究センター)内科レジデント 2007年大阪大学医学部附属病院老年・高血圧内科医員 2009年 米国Case Western Reserve大学 Case Cardiovascular Research Institute 研究員 2013年 大阪大学大学院医学系研究科老年・腎臓内科学助教 2015年 内科学再編に伴う改組にて同・研究科老年・総合内科助教 現在に至る
- 専門分野
- 老年医学、循環器内科、認知症

- 樂木 宏実(らくぎ ひろみ)
- 大阪大学大学院医学系研究科内科学講座(老年・総合内科)教授
- 最終学歴
- 1984年 大阪大学医学部卒
- 主な職歴
- 1985年 桜橋渡辺病院 循環器内科医員 1989年 米国Harvard 大学ブリガム・アンド・ウイミンズ病院内科研究員 1990年 米国Stanford 大学心臓血管内科研究員 1993年 大阪大学医学部老年病医学助手 2002年 大阪大学大学院医学系研究科加齢医学講師 2004年 同・研究科加齢医学助教授 2007年 同・研究科内科学講座(老年・腎臓内科)教授 2014年 大阪大学医学部附属病院副病院長(兼任) 2015年 内科学再編に伴う改組にて同・研究科老年・総合内科教授 現在に至る
- 専門分野
- 老年医学、高血圧学
- 主な学会役員
- 日本老年医学会(理事長 2015年~)、日本高血圧学会(理事)、日本心血管内分泌代謝学会(理事)
※筆者の所属・役職は執筆当時のもの
