第4章 認知症の予防 2.生活習慣病(3)脂質異常症
公開月:2019年10月
千葉大学大学院 医学研究院 細胞治療内科学講座
金子 ひより
千葉大学医学部附属病院 高齢者医療センター
千葉大学大学院 医学研究院 細胞治療内科学講座
石川 崇広
千葉大学大学院 医学研究院 細胞治療内科学講座 教授
横手 幸太郎
1.はじめに
我が国における高齢化は急速に進み、2017年における日本人の平均寿命は男女ともに過去最高を記録した。平均寿命の躍進の一方、日常生活に制限のない期間(健康寿命)の延びは平均寿命の延びと比較して小さいことが指摘されている。心疾患、脳血管疾患は我が国の総死亡の25%以上を占め、後遺症による健康寿命の短縮や、認知機能低下によるQOL低下も問題となる状況下で、動脈硬化の予防、脂質異常症管理は、今後益々重要な課題となっている。本稿では「動脈硬化性疾患予防ガイドライン2017」、「高齢者脂質異常症診療ガイドライン2017」、「認知症疾患診療ガイドライン2017」に基づき、高齢者における脂質異常症の管理、認知症との関連について文献的考察を加え述べる。
2.高齢者における脂質異常症と動脈硬化
1.脂質異常症の動脈硬化性疾患発症への影響
2014年における厚生労働省の患者調査では脂質異常症の総患者数は男性596,000人、女性1,465,000人、計2,062,000人と推定され、1996年の調査時点と比較して2.1倍にのぼる。2016年の国民健康・栄養調査では各年代において脂質異常症が疑われる人の割合は30歳代以降で加齢に伴い増加傾向であり、65-74歳では31.9%、75歳以上では32.9%であった。また、このうち薬を飲んでいる人の割合は65-74歳で83.9%、75歳以上で81.5%であり、高齢者における脂質異常症管理は重要な課題である。
NIPPON DATA801)や吹田研究2)では年齢階層の上昇に伴い動脈硬化性疾患の発症、および死亡リスクは増加し、加齢は動脈硬化性疾患の最も強い危険因子とされる。内閣府の平成29年版高齢社会白書では65歳以上で要介護が必要になった原因のうち、脳血管疾患、心臓病で全体の21.9%を占め、発症後の予後を考慮すると、一次予防、二次予防が重要となる。欧米の疫学調査においては、成人と同じく高齢者(主に前期高齢者:65歳以上75歳未満)でも高LDLコレステロール(以下、LDL-C)血症が冠動脈疾患の危険因子であることが明らかとなった。また、non-HDL-Cと動脈硬化性疾患との関連を見たNIPPON DATA903)によれば65歳以上の高齢者においてnon-HDL-Cと冠動脈疾患の間に有意な関係を認めた。我が国における10のコホート研究(65,594名)のメタ解析4)において(EPOCH-JAPAN)70歳から89歳の解析の結果、男性においては総コレステロール240mg/㎗以上で有意に冠動脈疾患死が増加した。しかし、女性では有意な関係が得られなかった。その一方でいずれの研究においても脳卒中と血清脂質に有意な関連を認めていない。前期高齢者の冠動脈疾患発症については高LDL-C血症の寄与が認められているが、後期高齢者においてはエビデンスの蓄積が不十分である。Cardiovascular Health Study5)では後期高齢者においてはLDL-Cは脳卒中、心筋梗塞、脳心血管死等の心血管イベントとの関連は示されなかった。後期高齢においては加齢自体の影響も大きいと考えられる。
2.高齢者における脂質異常症の治療、スタチンの冠動脈疾患予防効果
脂質異常症の治療の基本は食事療法・運動療法であり、高齢者も例外ではない。適切な総エネルギー摂取量の下での脂質エネルギー比率の制限、コレステロールの摂取量制限は動脈硬化性疾患発症予防に有用である。近年では肉の脂身や動物脂(牛脂、ラード、バター)を控え、大豆、魚、野菜、海藻、きのこ、果物、未精製穀物を取り合わせて食べる減塩した日本食パターンの食事が、動脈硬化性疾患予防に推奨されている。また、習慣的な身体活動や有酸素運動も動脈硬化性疾患予防に有効である。日本動脈硬化学会の「動脈硬化性疾患予防ガイドライン2017」の運動療法の簡易指針では、日常生活の中で身体活動を増やす工夫を行うとともに、有酸素運動を主とした中強度(通常速度のウォーキングに相当)の運動を一日合計30分以上、週3回以上(できれば毎日)実施することを目標としている。筋肉量が低下している高齢者の場合には軽度のレジスタンス運動を併用することも有用である。一方で、後期高齢者では厳格な食事療法の実行は栄養状態の悪化を招くことがあり、多くの認知症患者においては摂食障害・体重減少が問題になることから、低栄養にも注意する必要がある。また、運動療法も成人に対して行う運動療法と同等の運動の施行が困難なケースがあるため、個々の能力に応じた介入を行う。日本動脈硬化学会による「脂質異常症診療ガイド2018年版」では、生活習慣の改善で脂質管理が不十分な場合には、絶対リスクに応じた薬物療法が考慮されている。薬物療法の原則として、LDL-C低下が最も重要である。高LDL-C血症に対する第一選択薬はスタチンであるが、陰イオン交換樹脂(レジン)、小腸コレステロールトランスポーター阻害薬(エゼチミブ)およびPCSK9阻害薬も効果があり、家族性高コレステロール血症(FH)ホモ接合体患者ではMTP(Microsomal Triglyceride Transfer Protein)阻害薬(ロミタピド)も適応がある。治療はスタチン単剤で開始し、効果が不十分であればその増量もしくは併用療法を考慮する。急性冠症候群患者を対象としたエゼチミブのスタチンへの併用療法や、心筋梗塞、非出血性脳卒中、または末梢動脈疾患の既往のある患者を対象としたPCSK9阻害薬のスタチンへの併用療法は動脈硬化性疾患発症抑制効果がある。なお高リスク患者において、LDL-Cが管理目標値を達成してもTG(トリグリセライド)が高い場合、TGが400mg/㎗以上および食後採血の場合にはnon-HDL-Cを目標とした脂質管理を行う。TGが500mg/㎗以上の場合は急性膵炎の発症リスクが高いため、食事指導とともに薬物療法を考慮する。フィブラート系薬または選択的PPARαモジュレーターを第一選択薬とする。なお、これまで腎機能の臨床検査値に異常が認められる患者に対するスタチンとフィブラート系薬の併用は添付文書上、原則併用禁忌とされていたが、薬剤の有用性や安全性に関する調査結果を踏まえ、2018年10月より原則併用禁忌が解除となった。以上より、今後はスタチン内服下で高TG血症の患者に対して、フィブラート系薬の併用を考慮しやすい状況になると考えられる。なお、これまでと同様、併用時の横紋筋融解症に関する注意は必要である。
前述したようにスタチンは現在LDL-Cをもっとも効果的に低下させる薬剤のひとつである。二次予防患者を含む70歳から82歳を対象としたPROSPER試験でスタチン治療は高齢者の冠動脈疾患を有意に予防することが示された。一方本研究のサブ解析で75歳以上の高齢者において、スタチンの効果は二次予防においてのみ認められている6)。複数の一次予防試験においてスタチン治療の冠動脈疾患、脳卒中の予防効果が報告されており、MEGA Studyでは、65歳以上の冠動脈疾患+脳梗塞リスク低下は有意であり(ハザード比:0.60(0.39-0.93))高LDL-C血症を有する高齢者におけるスタチン治療の有効性が示された7)。少なくとも前期高齢者の一次予防のスタチン治療の有効性については確立しており、リスクに応じて薬物療法を行うことは推奨できる。一方、二次予防に関してはスタチンによる介入を行った60歳以上の高齢者51,351名を対象とした一次・二次予防を含めたメタ解析でも、スタチン治療はプラセボと比較して総死亡を15%減少させ(95%CI:7-22%)、冠動脈疾患死を23%減少させ(95%CI:15-29%)、致死性・非致死性心筋梗塞を26%減少させ(95%CI:22-30%)、致死性・非致死性脳卒中を24%(95%CI:10-35%)減少させた8)。65歳以上の高齢者を対象に含む二次予防介入試験における冠動脈疾患死リスクに対するメタ解析でも、高齢者に対する二次予防効果は若年者の成績から推測しうる以上に大きいとした報告もある9)。このように冠動脈疾患の既往のある高齢者におけるスタチンの二次予防効果は明らかであり、投与が推奨される。さらに、45歳から80歳の虚血性脳卒中既往患者(平均年齢66歳)に対しプラバスタチン10mgの有効性を検証した研究では一次エンドポイントで有意差はなかったもののアテローム血栓性脳梗塞の発症はスタチンにより67%減少した。本研究は対象者の平均年齢が66歳であり、約半数が高齢者であると予想される。後期高齢者の冠動脈疾患の一次予防効果の意義についてはエビデンスが少なく、加齢自体の予後に与える影響が大きいと考えられる。但し、75歳以上の高齢者における一次予防の意義については明らかでなく、個々の患者への対応は主治医の判断による。
3.スタチンの副作用
上述のようにスタチンの高齢者投与による心血管イベント発症リスク低下が認められているが、副作用の発現についての報告も多く認める。スタチン使用の成人非糖尿病患者91,140名を対象とした13試験のメタ解析ではスタチンにより糖尿病の新規発症が9%増加することが示され(95%CI:1.02-1.17)、加齢とともに糖尿病の新規発症は増加傾向にあった10)。一方65歳以上の一次予防患者25,952名を対象とした8試験のメタ解析では心血管イベント、非致死性心筋梗塞についてはリスク低下を認めたが、筋肉痛の発症(相対リスク0.88,95%CI:0.69-1.13)、肝酵素上昇(相対リスク0.98,95%CI:0.71-1.34)、新規糖尿病発症(相対リスク1.07,95%CI:0.77-1.48)、重篤な有害事象(相対リスク1.00,95%CI:0.97-1.04)については有意差を認めなかった11)。糖尿病の新規発症に関して、2つのメタ解析で相反する結果が得られたが、日本老年医学会の「高齢者脂質異常症診療ガイドライン2017」では前者の結果を重視し、スタチンは高齢者における糖尿病の新規発症を増加させると結論づけている。しかし、スタチンによる新規糖尿病の発症は用量依存性が示唆され、定期的に血糖値等をモニターし、適切なスタチン使用量を検討することが求められている。また、高齢者は併存疾患、臓器障害、薬物代謝能低下、症状の非定型性、低栄養、多剤投与等、スタチンの投与時により配慮が必要である。
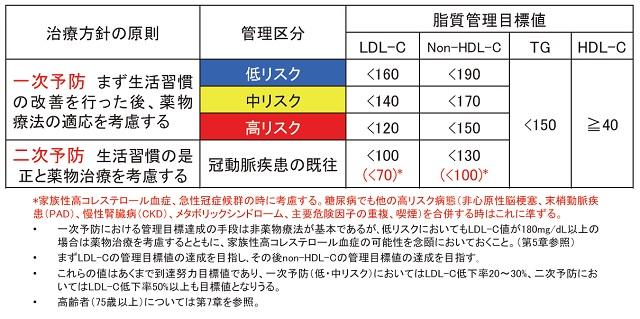
4.動脈硬化性疾患の脂質管理目標値
これまでの大規模臨床試験の結果を受け、日本動脈硬化学会の「動脈硬化性疾患予防ガイドライン2017年版」では、LDL-Cの管理対象年齢を40歳から74歳以下としている。ただし上述したように加齢は動脈硬化の重要なリスクファクターであり、高齢者のほうが成人に比べ動脈硬化性疾患のリスクが高い。また、危険因子の個数と絶対リスクの解離は年齢と性に起因するものである。2012年版のガイドラインでは年齢、性別を考慮し危険因子の個数をカウントし、おおよその絶対リスクの推計をしている。2017年版のガイドラインでは「日本人の動脈硬化性疾患の発症・死亡を予測する評価法は存在しているか」という観点から吹田研究が選択され、吹田スコアに基づいた層別化が行われた。すなわち、年齢、性別、喫煙、血圧、HDL-C、LDL-C、耐糖能異常症、早発性冠動脈疾患家族歴の8項目の危険因子の点数を合算し、合計点によりリスクの推計を行っている。各群の得点分布は低リスク群で39~41点、中リスク群で42~56点、高リスク群で49~71点となりそれぞれのリスク毎に管理目標値が設定される。吹田スコアに併記して、性、年齢、危険因子(1.喫煙、2.高血圧、3.低HDL-C血症、4.耐糖能異常、5.早発性冠動脈疾患家族歴)の個数に対する層別化のチャートも作成された。リスク評価が異なっており、その点が2012年版ガイドラインとの違いとして注意が必要である。糖尿病、CKD、非心原性脳梗塞または末梢動脈疾患のいずれかを有する症例は年齢にかかわらず高リスクと判断され、LDL-C120mg/㎗未満、HDL-C≧40mg/㎗、TG<150mg/dlを目標とする。なお冠動脈疾患の既往がある場合は二次予防となりLDL-C100mg/dl未満が目標となるが、さらに家族性高コレステロール血症や急性冠症候群を合併している例では、LDL-C70mg/㎗未満といったより厳格な管理目標を考慮する(表1)。
表1 リスク区分別脂質管理目標値
(日本動脈硬化学会(編):動脈硬化性疾患予防ガイドライン2017年版.20179)より引用)
3.認知症と脂質異常症
1.認知症の原因・動向
認知症においても加齢は大きな危険因子の一つである。その他にも遺伝的危険因子、血管性危険因子(高血圧、糖尿病、脂質異常症)、関連する疾患(メタボリック症候群、睡眠時無呼吸症候群、うつと双極性障害)、後天的な要素としては教育歴、頭部外傷等が含まれる12)。厚生労働省の平成25年の国民生活基礎調査によると65歳以上の要介護者等の介護が必要になった主な原因として脳血管疾患に次いで認知症が16.4%を占めている。脳卒中既往患者25,217名を対象としたメタアナリシスでは脳卒中の既往は認知症発症リスクを約2倍に増加させた。認知症の病型割合としては2010年代前半の全国調査ではアルツハイマー病が67.6%で最も多く、次いで血管性認知症が19.5%、Lewy小体型認知症/認知症を伴ったParkinson病が4.3%であった13)。血管性認知症と比してアルツハイマー病は年々増加傾向であり、他の認知症と比較して今後も増加が予想される14)。
2.脂質異常症の認知症発症への影響
脂質異常症自体と認知症発症との関連については中年期における高コレステロール血症が老年期におけるアルツハイマー病発症のリスクを有意に上昇させたとする報告もあるが15)、総コレステロール高値の方が認知症発症低下と関連するとする報告や16)、関連がないとする報告もあり17)、少なくともアルツハイマー病とLDL-C値については一定の見解を得ていない。また、高齢者における血清トリグリセライド値と認知症発症については十分なエビデンスはなく、HDL-Cレベルとの関連については一定の傾向は認められていない。スタチンの認知症予防効果については観察研究、介入研究の結果が報告されているが、サブ解析、二次エンドポイントによる報告が多く、認知機能を一次エンドポイントにした研究ではサンプル数が少ない。冠動脈疾患を有する閉経後女性1,037名を対象とした観察研究ではスタチン治療による認知症発症リスク抑制効果が示唆されたが18)、一定の傾向を認めていない。また、最近のCochrane reviewにおいてはアルツハイマー病患者に対しスタチン介入した4研究についてのメタ解析が行われた。その結果、いずれの研究においても介入群とプラセボ群とでAlzheimer's Disease Assessment Scalecognitivesubscale(ADAS-Cog)、MiniMental State Examination(MMSE)の投薬前からの変化、全般的な生活機能、活動に有意差を認めなかった19)。
以上より、スタチンによるアルツハイマー病の予防及び治療効果は否定的と考えられる。認知症には種々の原因疾患があるが、上述したようにアルツハイマー型認知症は全体の過半数を占める。アルツハイマー型認知症は、病理学的に神経原線維変化(tauopathy)とアミロイド(Aβ amyroidosis)蓄積の2つの変化を特徴とし、大脳皮質、海馬、前脳底部で神経細胞死、シナプス減少、アセチルコリン低下が起こり、認知症を発症した段階である。2011年に米国国立老化研究所(National Institute on Aging:NIA)とAlzheimer協会(Alzheimer's Association:AA)による認知症とAlzheimer型認知症の診断基準が提案され、アミロイド蓄積のバイオマーカーとしては脳脊髄液Aβ42低下とPiBアミロイドPETによるAβ蓄積も記載された20)。スタチンの認知症予防及び改善効果は否定的ではあるが、スタチンのAβ低下作用、クリアランス増加作用の報告や21)、認知機能障害のない中年成人におけるPiB-PETでのアミロイド集積と血清LDL-Cレベル、血清HDL-Cレベルの関連についての報告もある22)。一方で臨床でのスタチン使用量とAβ産生について否定的な報告も複数あり23)一定の見解を得ていない。一方、脳卒中は認知症発症のリスクを約2倍に増やすこと、スタチンは脳卒中の発症を減らすことから、スタチンは血管性認知症の予防効果があると考えられる。ただし、血管性認知症患者に対するスタチンの介入効果をみた研究はない。アルツハイマー病の原因遺伝子については複数の報告を認める。apolipoprotein E(ApoE)はHDL、VLDL、LDLなどのリポ蛋白を構成するアポ蛋白の一つである。HDLを通してコレステロール代謝を司るApoEの対立遺伝子の一つである24)。1993年より、ApoE4はアルツハイマー病発症と有意な関係があることが多くの論文で示されている25,26)。ApoE遺伝子にはE4以外にもE2、E3と計3つの対立遺伝子があるが、メタ解析でもE4は認知症発症と有意に関連することが明らかとなった。ε2は認知症の発症率低下と関係し、ε4は認知症発症と有意に関連していた。ε4を有するものはε3/ε3に比べ、3.18倍認知症の発症率が高かった27)。
3.認知症と日常生活動作(ADL)
アルツハイマー型認知症では進行すると最終的には整容、着衣、食事、トイレ、入浴などのセルフケア、言語の理解や発語もできなくなり、立つ、座る、歩くなどの基本的な運動能力の喪失へと進行し、寝たきり状態となる。末期の低栄養や脱水、誤嚥性肺炎などの感染症の合併症によって死亡する20)。サルコペニアは加齢に伴って筋肉量が減少し、筋力、歩行速度の低下を来たし、転倒、骨折だけではなく心血管イベントにも影響を及ぼすことが示唆されている28)。一方、フレイルとは、加齢に伴う様々な機能変化や予備能低下によって健康障害に対する脆弱性が増加した状態である29)。Whiteらは65歳以上の非ST上昇型急性冠症候群患者をFriedの基準を用いてフレイル、プレフレイル、非フレイルの3群に分けて前向きに追跡をしたところ、フレイル群は非フレイル群に比べ一次エンドポイントである心血管死、心筋梗塞、脳卒中が優位に増加し(HR:1.76;95%CI:1.36-2.28)、総死亡も有意に増加した(HR:1.98;95%CI:1.47-2.68)30)。高齢者において、フレイルも心血管イベントの危険因子であることが示唆された。認知症高齢者では脳機能正常の高齢者と比較して、サルコペニア、フレイルを合併しやすい傾向にあり31)、レジスタンス運動は認知症に合併したサルコペニア、フレイル改善に有効な可能性がある。ApoE4と身体機能に関する報告としては、オランダの1,262名の65歳以上の高齢者を対象とした6年間の追跡調査がある。この研究ではApoE4を有する人はApoE3/E3の人に比べ、歩行スピードが0.4m/秒以下であることが多く(オッズ比2.26 95%CI:1.31-3.90)、5回立ち上がりテストに20秒以上時間がかかる人が多かった(オッズ比1.94 95%CI:1.19-3.16)。6年後においてApoE4を有する人はApoE3を有する人に比べ、5回立ち上がりテストに要する時間が20秒以上になる場合が多かった(オッズ比1.89 95%CI:1.08-3.31)。しかしながら、認知機能を検査していないため断定はできないが、アルツハイマー病による身体機能の低下を反映している可能性もある。脂質異常症と日常生活動作(ADL)低下の関連についてはNIPPON DATA90において日本人の65歳以上の高齢者1,222人を5年間追跡している。高血圧、糖尿病、高コレステロール血症、低HDL-C血症、高トリグリセライド(TG)血症、肥満、喫煙の7つの危険因子のうち、持っている数と5年後の手段的ADL(IADL)の変化との関係を見た結果、危険因子数が多いほどIADLの低下は大きかった。その一方でIADLの変化について総コレステロール240mg/㎗以上/未満、G150mg/㎗以上/未満、HDLコレステロール40mg/㎗以上/未満で分けた場合には有意差を認めず、女性の低HDLコレステロールのみで有意差を認めた32)。スタチンには筋障害の副作用があり、長期連用によるサルコペニアのリスクが懸念されているが、Lynchらは、リハビリテーション中の高齢者(3,422名、平均年齢81.4歳)におけるスタチン使用がADL改善と関連したと報告している33)。また、末梢動脈疾患を有する患者332名、末梢動脈疾患を有さない患者212名における縦断研究において、3年間追跡した結果、末梢動脈疾患のない患者ではスタチンの効果は認めなかったものの、スタチン服用者は非服用者に比べて、歩行速度の低下が有意に少なく、6分間歩行距離の低下も少なかった34)。スタチン治療のADLへの影響についての検討はほとんど行われておらず、今後もより長期の試験が必要であるが、末梢動脈疾患を有する患者においてはスタチンによる治療は下肢機能の低下を抑制する可能性が考えられる。
4.おわりに
加齢は動脈硬化の最大の危険因子とされ、超高齢社会を迎えた我が国において心疾患、脳血管疾患の予防は重要な課題である。高齢者の脂質管理については前期高齢者では高コレステロール血症は冠動脈疾患の重要な危険因子であり、スタチン治療予防効果が期待できる。後期高齢者においてはエビデンスの蓄積が少なく、個々の対応が求められる。一方、認知症と脂質異常症の関連、スタチン治療による認知症予防効果については一定の報告を得ていない。しかし、ADLが課題となる認知症においてスタチン治療がADL改善につながり得る可能性もあり、今後も個々に応じた慎重な検討が求められる。
文献
プロフィール

- 金子 ひより(かねこ ひより)
- 千葉大学大学院 医学研究院 細胞治療内科学講座
- 最終学歴
- 2014年 信州大学医学部医学科卒
- 主な職歴
- 2014年 国立病院機構千葉医療センター初期研修医 2016年 千葉大学医学部附属病院糖尿病・代謝・内分泌内科シニアレジデント 2017年 聖隷佐倉市民病院腎臓内科研修医 2017年 国保直営総合病院君津中央病院糖尿病・内分泌・代謝内科後期研修医 2018年 千葉大学医学部附属病院細胞治療内科学大学院生 現在に至る

- 石川 崇広(いしかわ たかひろ)
- 千葉大学医学部附属病院 高齢者医療センター 千葉大学大学院 医学研究院 細胞治療内科学講座
- 最終学歴
- 2005年 大分大学医学部卒
- 主な職歴
- 2005年 千葉大学医学部附属病院医員(研修医) 2006年 松戸市立病院研修医 2007年 千葉大学医学部附属病院医員(後期研修医) 2007年 成田赤十字病院後期研修医 2013年 千葉大学大学院医学薬学府博士課程(医学系)修了、千葉大学細胞治療内科学/糖尿病・代謝・内分泌内科医員 2014年 千葉大学医学部附属病院高齢者医療センター特任助教 現在に至る
- 最近の活動
- 高齢者医療センターにおける大学病院での高齢者チーム医療(特にポリファーマシーとフレイルに関して)、高齢者糖尿病における低血糖リスク因子の解析

- 横手 幸太郎(よこて こうたろう)
- 千葉大学大学院 医学研究院 細胞治療内科学講座 教授
- 最終学歴
- 1988年 千葉大学医学部医学科卒
- 主な職歴
- 1988年 同第二内科入局 1989年 東京都老人医療センター医員 1992年 ルードウィック癌研究所(スウェーデン)客員研究員 1996年 スウェーデン国立ウプサラ大学大学院博士課程修了(PhD)1998年 千葉大学大学院博士課程修了(医学博士)、日本学術振興会特別研究員 1999年 千葉大学助手 2006年 同・講師 2009年 千葉大学大学院医学研究院細胞治療内科学(旧第二内科)教授、同・糖尿病・代謝・内分泌内科科長 2011年 千葉大学医学部附属病院副病院長併任 2015年 同・副研究院長併任 現職 千葉大学大学院医学研究院 細胞治療内科学教授、千葉大学医学部附属病院副病院長、千葉大学大学院医学研究院副研究院長
- 主な研究テーマ
- 生活習慣病および合併症の成因解明と治療、早老症
※筆者の所属・役職は執筆当時のもの
PDFダウンロード
